nowotwór resekcyjny

Wczesne stadium zaawansowania NDRP

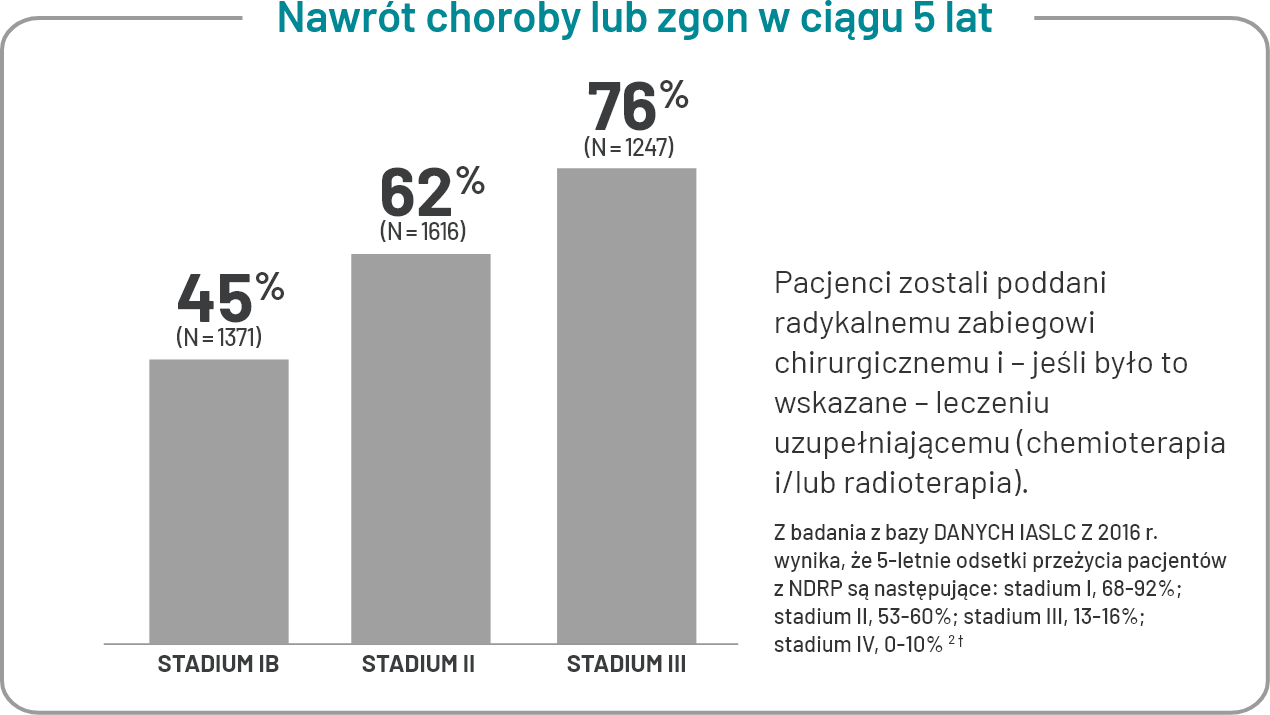
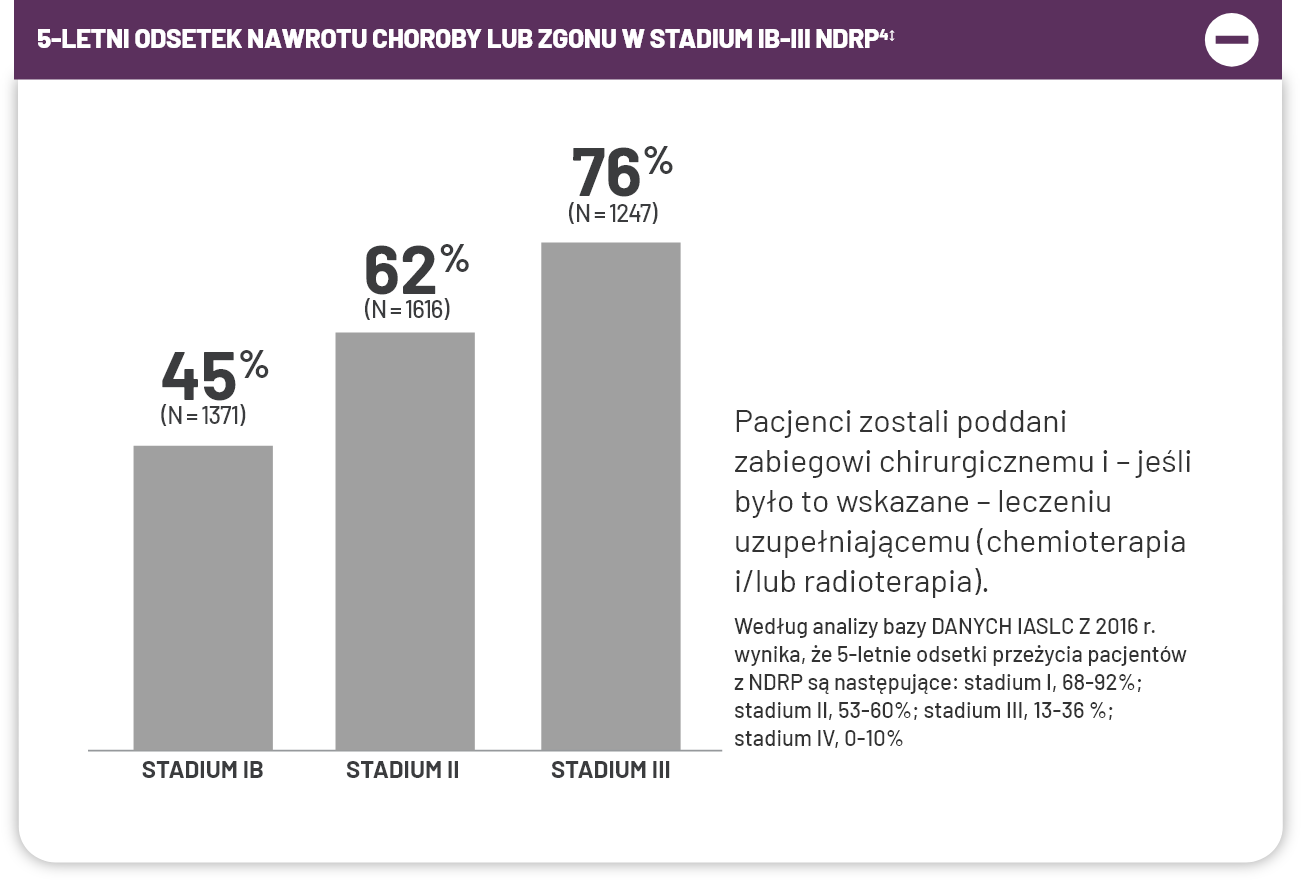
U większości pacjentów z NDRP w stadium zaawansowania IB-III kwalifikujących się do resekcji guza wystąpi nawrót choroby lub zgon w ciągu 5 lat, niezależnie od tego, czy otrzymują leczenie adjuwantowe chemioterapią1*.
Pacjenci w stadium I-III z mutacjami EGFR mogą mieć większe ryzyko nawrotu choroby3§.
-
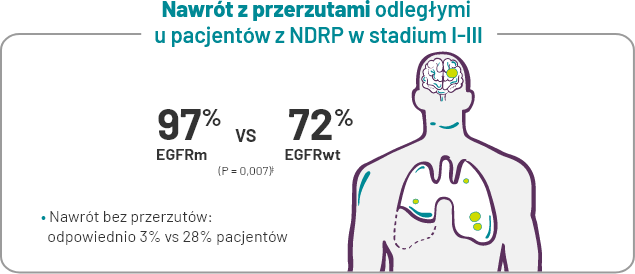
Analiza retrospektywna wykazała, że spośród pacjentów, u których doszło do nawrotu choroby, większość pacjentów z NDRP z mutacją EGFR miało odległe przerzuty w porównaniu z pacjentami bez zaburzeń molekularnych.


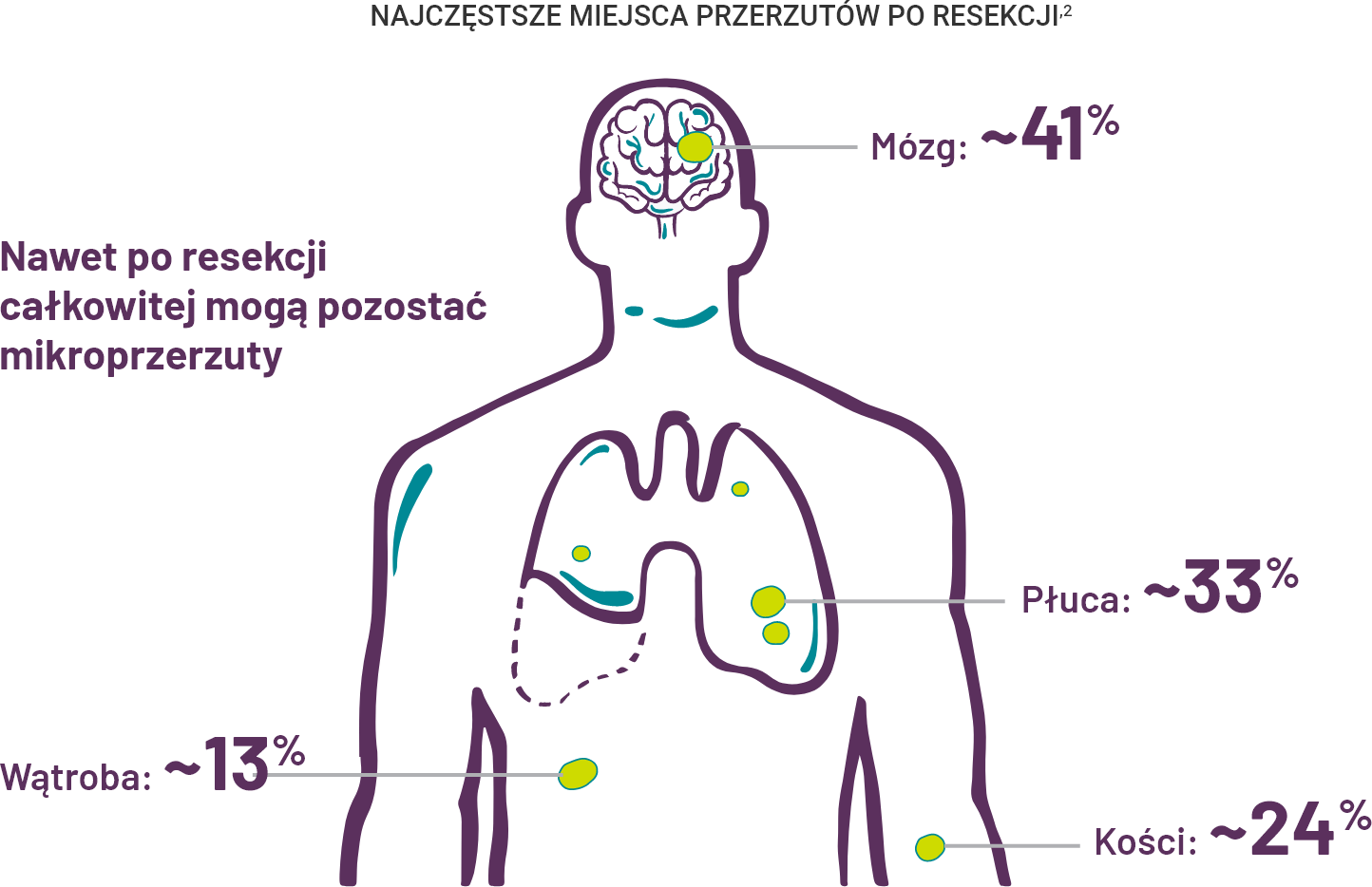
Kluczowe znaczenie ma zapobieganie nawrotom z przerzutami.
*Zbiorcza analiza 5 randomizowanych badań z udziałem 4584 pacjentów; w badaniach porównywano zastosowanie pooperacyjnej chemioterapii opartej na cisplatynie z brakiem chemioterapii lub chemioterapię opartą na cisplatynie + pooperacyjną radioterapię (podawaną sekwencyjnie) z samą pooperacyjną radioterapią u pacjentów z NDRP po całkowitej resekcji1.
†Pacjenci kwalifikujący się do resekcji guza.
‡W oparciu o 8. wydanie klasyfikacji TNM dla nowotworu płuc opracowaną przez AJCC2.
§Na podstawie jednoośrodkowego retrospektywnego badania z udziałem 282 pacjentów z wczesnym lub miejscowo zaawansowanym stadium gruczolakoraka płuc; 142 miało mutację EGFR, a 140 mutację EGFR typu dzikiego. Większość pacjentów w obu grupach była poddawana standardowemu leczeniu. Standard opieki określono jako zabieg chirurgiczny lub, w stosownych przypadkach, radioterapię + chemioterapię opartą na cytotoksycznych dubletach platyny3.
IIOgólny odsetek nawrotów we wszystkich stadiach wyniósł ~23% u pacjentów z mutacją EGFR i ~21% u pacjentów bez mutacji EGFR. P – wartość odpowiada danym obliczeniowym 21/29 = 0,72 i 31/32 = 0,97. Wartość P wynosząca 0,007 dotyczyła całej populacji (stadium I–III). Jedyną istotną wartość P wykazano dla stadium I (P = 0,02)3.
¶Na podstawie metaanalizy, w ramach której zbadano częstość występowania przerzutów do mózgu w NDRP z EGFRm lub EGFR typu dzikiego. 8152 pacjentów włączono do 22 badań międzynarodowych. 16 badań obejmowało pacjentów z chorobą w stadium IV. 2664 pacjentów miało mutację EGFR.

Pomimo całkowitej resekcji guza, niewykrywalne mikroprzerzuty prowadzące do nawrotu choroby mogą pozostać1.
~40% pacjentów leczonych chemioterapią adjuwantową doświadcza nawrotu NDRP z przerzutami3†.
*Chouaid i in. (2018) przeprowadzili retrospektywne badanie obserwacyjne z udziałem 831 pacjentów z NDRP w stadium IB-IIIA, po całkowitej resekcji guza, bez informacji o statusie EGFRm. Spośród 831 pacjentów u 200 wystąpił nawrót z przerzutami w okresie obserwacji2.
†Badanie obejmowało łącznie 1867 pacjentów w stadium I-III, z 932 pacjentami losowo przydzielonymi do grupy chemioterapii i 935 pacjentami przydzielonymi do grupy kontrolnej (bez chemioterapii). Z całej populacji 36% pacjentów było w stadium I, 24% w stadium II, a 40% w stadium III. Spośród 284 pacjentów w grupie chemioterapii i 288 pacjentów w grupie kontrolnej, którzy byli poddani adjuwantowej radioterapii, leczenie otrzymywało odpowiednio tylko 70,4% i 84,2%3,6.
‡Zbiorcza analiza 5 randomizowanych badań z udziałem 4584 pacjentów; w badaniach porównywano pooperacyjną chemioterapię opartą na cisplatynie z brakiem chemioterapii lub chemioterapię opartą na cisplatynie + pooperacyjną radioterapię (podawaną sekwencyjnie) z samą pooperacyjną radioterapią u pacjentów z NDRP po całkowitej resekcji4.
§Pacjenci kwalifikujący się do resekcji guza.
||W oparciu o 8. wydanie klasyfikacji TNM dla nowotworu płuc opracowane przez AJCC5.

Kluczowe znaczenie ma zapobieganie nawrotom z przerzutami.
*Penault-Llorca, F., Kerr, K. M., Garrido, P., Thunnissen, E., Dequeker, E., Normanno, N., … Moch, H. (2022). Expert opinion on NSCLC small specimen biomarker testing — Part 2: Analysis, reporting, and quality assessment. Virchows Archiv, 481, 351–366. https://doi.org/10.1007/s00428-022-03344-1
†Na podstawie jednoośrodkowego retrospektywnego badania z udziałem 282 pacjentów z wczesnym lub miejscowo zaawansowanym stadium gruczolakoraka płuc; 142 pacjentów miało mutację EGFR, a 140 pacjentów mutację EGFR typu dzikiego. Większość pacjentów w obu grupach była poddawana standardowemu leczeniu. Standard opieki określono jako zabieg chirurgiczny lub, w stosownych przypadkach, radioterapię + chemioterapię opartą na cytotoksycznych dubletach platyny10.
‡Ogólny wskaźnik nawrotów we wszystkich stadiach wyniósł ~23% u pacjentów z dodatnim wynikiem EGFRm i ~21% u pacjentów z EGFR typu dzikiego. P – wartość odpowiada danym obliczeniowym 21/29 = 0,72 i 31/32 = 0,97. Wartość P wynosząca 0,007 dotyczyła całej populacji (stadium I–III). Jedyną istotną wartość P wykazano dla stadium I (P = 0,02)10.
§Na podstawie metaanalizy, w ramach której zbadano częstość występowania przerzutów do mózgu w NDRP z mutacją EGFR lub bez mutacji EGFR. 8152 pacjentów włączono do 22 badań międzynarodowych. 16 badań obejmowało pacjentów z chorobą w stadium IV. 2664 pacjentów miało mutację EGFR11.
Expert opinion on NSCLC small specimen biomarker testing — Part 2: Analysis, reporting, and quality assessment12.
Strategie kierowania pacjentów na diagnostykę
Różne strategie mogą pomóc zwiększyć odsetek pacjentów kierowanych przez chirurgów do onkologów.
-
Skonsultuj się z zespołem multidyscyplinarnym, aby upewnić się, że wszyscy pacjenci z NDRP po doszczętnej resekcji guza zostali poddani diagnostyce pod kątem mutacji EGFR i skierowani do onkologów w celu uzyskania możliwości terapii adjuwantowej lekiem TAGRISSO14.
Należy kierować każdego kwalifikującego się pacjenta z NDRP z mutacją EGFR, po resekcji guza, do lekarza onkologa tak wcześnie, jak to możliwe w celu skorzystania z możliwości oferowanych przez Program Lekowy B.6.25
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
AJCC, Amerykański Wspólny Komitet ds. raka; CI, przedział ufności; OUN, ośrodkowy układ nerwowy; DFS, przeżycie wolne od choroby; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; HR, współczynnik ryzyka; IASLC, Międzynarodowe Stowarzyszenie Badań nad Rakiem Płuc; L858R, substytucja leucyny 858 argininą w eksonie 21; MDT, zespół multidyscyplinarny; NC, niemożliwe do obliczenia; NCCN®, National Comprehensive Cancer Network®; NE, niemożliwe do oszacowania; NDRP, niedrobnokomórkowy rak płuca; OR, iloraz szans; po, doustnie; qd, raz na dobę; RT, radioterapia; TKI, inhibitor kinazy tyrozynowej.
1. Uramoto H, Tanaka F. Recurrence after surgery in patients with NSCLC. Transl Lung Cancer Res. 2014;3(4):242-249.
2. Chouaid C, Danson S, Andreas S, et al. Adjuvant treatment patterns and outcomes in patients with stage IB-IIIA non-small cell lung cancer in France, Germany, and the United Kingdom based on the LuCaBIS burden of illness study. Lung Cancer. 2018;124:310-316.
3. Arriagada R, Dunant A, Pignon JP, et al. Long-term results of the international adjuvant lung cancer trial evaluating adjuvant cisplatin-based chemotherapy in resected lung cancer. J Clin Oncol. 2010;28(1):35-42.
4. Pignon JP, Tribodet H, Scagliotti GV, et al; LACE Collaborative Group. Lung Adjuvant Cisplatin Evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26(21):3552–3559.
5. Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Termoc Oncol. 2016;11(1):39-51.
6. Arriagada R, Bergman B, Dunant A, Le Chevalier T, Pignon JP, Vansteenkiste J. Cisplatin-based adjuvant chemotherapy in patients with completely resected non-small-cell lung cancer. N Engl J Med. 2004;350(4):351-360.
7. Sholl LM, Aisner DL, Varella-Garcia M, et al; LCMC Investigators. Multi-institutional oncogenic driver mutation analysis in lung adenocarcinoma: The Lung Cancer Mutation Consortium experience. J Termoc Oncol. 2015;10(5):768-777 [załącznik uzupełniający].
8. D’Angelo SP, Janjigian YY, Ahye N, et al. Distinct clinical course of EGFR-mutant resected lung cancers: results of testing of 1118 surgical specimens and effects of adjuvant gefitinib and erlotinib. J Termoc Oncol. 2012;7(12):1815-1822.
9. Jordan EJ, Kim HR, Arcila ME, I in. Prospective comprehensive molecular characterization of lung adenocarcinomas for efficient patient matching to approved and emerging therapies. Cancer Discov. 2017;7(6):596-609.
10. Galvez C, Jacob S, Finkelman BS, et al. The role of EGFR mutations in predicting recurrence in early and locally advanced lung adenocarcinoma following definitive therapy. Oncotarget. 2020;11(21):1953-1960.
11. Li L, Luo S, Lin H, et al. Correlation between EGFR mutation status and the incidence of brain metastases in patients with non-small cell lung cancer. J Thorac Dis. 2017;9(8):2510-2520.
12. Sholl LM, Aisner DL, Varella-Garcia M, et al; LCMC Investigators. Multi-institutional oncogenic driver mutation analysis in lung adenocarcinoma: The Lung Cancer Mutation Consortium experience. J Termoc Oncol. 2015;10(5):768-777.
13. Kris MG, Johnson BE, Berry LD, I in. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014;311(19):1998-2006.
14. Charaketrystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024].
15. Tsuboi M, Wu YL, Grohe C, et al. Osimertinib as adjuvant therapy in patients with resected EGFRm stage IB–IIIA NSCLC: updated results from ADAURA. Przedstawiono podczas: Kongres ESMO 2022; 9–13 września 2022 r.; Paryż, Francja.
16. Wu YL, Tsuboi M, He J, I in. Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med. 2020;383(18):1711-1723 [protocol].
17. Cytowane za zgodą NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.5.2022. ©National Comprehensive Cancer Network, Inc. 2022. Wszystkie prawa zastrzeżone. Dostęp 26 września 2022 r. Aby przejrzeć najnowszą i kompletną wersję wytycznych, odwiedź stronę NCCN.org. NCCN nie udziela żadnych gwarancji dotyczących treści, ich użytkowania lub zastosowania oraz zrzeka się wszelkiej odpowiedzialności za ich zastosowanie lub użytkowanie w dowolny sposób.
18. Wu YL, Tsuboi M, He J, I in. Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med. 2020;383(18):1711-1723.
19. Freeman RK, Ascioti AJ, Dake M, Mahidhara RS. The effects of a multidisciplinary care conference on the quality and cost of care for lung cancer patients. Ann Thorac Surg. 2015;100(5):1834-1838.
20. Bilfinger TV, Albano D, Perwaiz M, Keresztes R, Nemesure B. Survival outcomes among lung cancer patients treated using a multidisciplinary team approach. Clin Lung Cancer. 2018;19(4):346-351.
21. Wang J, Kuo YF, Freeman J, Goodwin JS. Increasing access to medical oncology consultation in older patients with stage II-IIIA non-small- cell lung cancer. Med Oncol. 2008;25(2):125-132.
22. Postmus PE, Kerr KM, Oudkerk M, et al; ESMO Guidelines Committee. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28(suppl4):iv1-iv21.
23. Zuccato JA, Ellis PM. Improving referral of patients for consideration of adjuvant chemotherapy after surgical resection of lung cancer. Curr Oncol. 2012;19(6):e422–e427.
24. Hirsch FR, Kerr KM, Bunn PA Jr, et al. Molecular and immune biomarker testing in squamous-cell lung cancer: effect of current and future therapies and technologies. Clin Lung Cancer. 2018;19(4):331-339.
25. Obwieszczenie Ministra Zdrowia z dnia 11 grudnia 2023 r. w sprawie wykazu refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych na 1 stycznia 2024 r. Załącznik B.6.
Mutacje EGFR
Mutacje EGFR stymulują wzrost nowotworu i występują niezależnie od stadium choroby. Nawet ok. 15% chorych na NDRP może mieć mutację EGFR5.
U pacjentów z NDRP z mutacją EGFR w stadium IB-III, kwalifikujących się do resekcji guza, może również wystąpić ekspresja PD-L16.

rekomendacje Polskie oraz międzynarodowe
Należy wykonać diagnostykę u wszystkich pacjentów kwalifikujących się do zabiegu operacyjnego (stadium IB-IIIA NDRP) pod kątem obecności mutacji EGFR z tkanki po zabiegu chirurgicznym lub biopsji7†, i, ii, iii.
W NDRP z mutacją w genie EGFR — należy jak najszybciej określić status EGFR, aby podjąć decyzję o odpowiednim leczeniu uzupełniającym.
*Częstość występowania mutacji EGFR w gruczołowym NDRP oparto na danych z 3 badań: w badaniu Sholl i in. (2015) przeprowadzono analizę mutacji na 1007 chorych z potwierdzoną diagnozą gruczolakoraka płuc z mutacjami w genie EGFR (delecje w eksonie 19, mutacje L858R w EGFR, mutacje G719X w EGFR, mutacje L861Q w EGFR) i innych mutacjach EGFR (jakakolwiek jedna lub więcej mutacji w EGFR innych niż delecje w eksonie 19, mutacje L858R, mutacje G719X lub mutacje L861Q); D’ Angelo i in. (2012) przeanalizowali próbki nowotworów z kohorty 1118 pacjentów z gruczolakorakiem płuc po resekcji guza w stadium I–III z delecją w eksonie 19 w genie EGFR i mutacjami L858R; Jordan i in. (2017) przeanalizowali materiał u 860 pacjentów z gruczolakorakiem płuc w IV stadium z mutacjami w genie EGFR (delecje/insercje w eksonie 19 i mutacje L747P; mutacje eksonu 21 L858R i L861Q; eksonu 18 E709_T710delinsD, G719A, E709K + G719S, E709K + G719A + G719S; G719C + S768I, G719S + S768I, G719A + L861Q, G719A + S768I; EGFR-KDD), mutacje T790M w EGFR oraz insercje w eksonie 20 w EGFR i mutacje H773R5,8,9.
†Status mutacji EGFR i nakładanie się ekspresji PD-L1 badano w retrospektywnej analizie u 319 pacjentów z NDRP z mutacją EGFR we wszystkich stadiach. Mutacje EGFR obejmowały delecje w eksonie 19 (n = 145), mutacje w eksonie 21 L858R (n = 121), brak delecji w eksonie 19 (n = 26), mutacje w eksonie 21 inne niż L858R (n = 3), mutacje w eksonie 18 (n = 12) oraz mutacje w eksonie 20 (n = 8). U jednego pacjenta występowały zarówno mutacje w eksonie 18, jak i eksonie 20, a u 3 pacjentów występowały inne mutacje. Ekspresję PD-L1 ≥1% obserwowano u 86 ze 150 pacjentów z NDRP z mutacją EGFR w stadium IB-IIIA6.
Diagnostyka
Należy wykonać badanie pod kątem występowania mutacji w genie EGFR jak najszybciej to możliwe.
rekomendacje Polskie oraz międzynarodowe
W wytycznych zaleca się przeprowadzenie badań molekularnych na obecność mutacji EGFR u pacjentów z NDRP kwalifikujących się do resekcji w stadiach od IB do IIIA w celu podjęcia decyzji o odpowiednim leczeniu uzupełniającym7, i, ii, iii, †.
Konsylium podejmuje decyzje dotyczące każdego pacjenta z NDRP kwalifikującego się do zabiegu operacyjnego, aby wdrożyć odpowiednie leczenie.
*Możliwość zastosowania terapii uzupełniającej po resekcji guza zależy od przypadku pacjenta. W przypadku badania ADAURA pacjenci przyjmujący lek TAGRISSO lub placebo zostali uprzednio poddani zabiegowi całkowitej resekcji guza. Pacjenci, którzy nie otrzymywali chemioterapii uzupełniającej po operacji, zostali zrandomizowani do 10 tygodni po operacji, a pacjenci, którzy otrzymywali chemioterapię uzupełniającą po operacji, zostali zrandomizowani do 26 tygodni po operacji11.
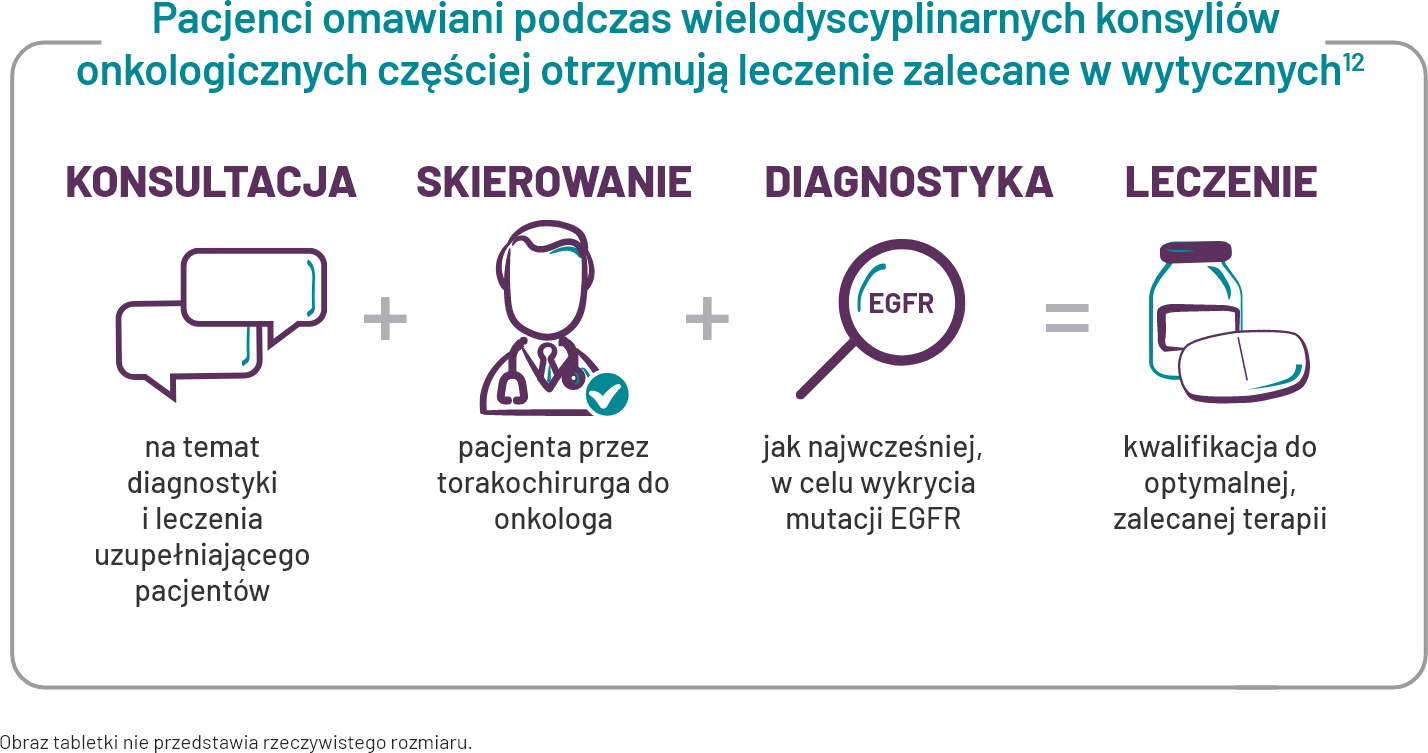
Konsultacja, diagnostyka, leczenie
Każdy pacjent powinien zostać poddany diagnostyce pod kątem mutacji w genie EGFR w celu ustalenia optymalnego leczenia uzupełniającego.
rekomendacje Polskie oraz międzynarodowe
W wytycznych zaleca się przeprowadzenie diagnostyki molekularnej na obecność mutacji EGFR u pacjentów z NDRP kwalifikujących się do resekcji w stadiach od IB do IIIA w celu podjęcia decyzji o odpowiednim leczeniu uzupełniającym4, i, ii, iii.
Diagnostyka molekularna i terapia uzupełniająca to integralna część prawidłowego planu leczenia pacjenta.
* Retrospektywna analiza kohortowa, w której wykorzystano bazę danych pacjentów hospitalizowanych Premier w celu identyfikacji pacjentów ze zdiagnozowanym NDRP, którzy byli leczeni w 77 szpitalach w ramach systemu szpitalnego Ascension Health w okresie 5 lat od 2008 r. do 2012 r. Do analizy kwalifikowali się pacjenci z NDRP w stadium I–III. W celu podziału pacjentów na 2 kohorty zastosowano metodę oceny skłonności: pacjenci objęci opieką koordynacją w ramach zespołów wielodyscyplinarnych oraz tych, których opieka nie była koordynowana przez MDT. W 6-letnim okresie badania zidentyfikowano 15 731 pacjentów z NDRP zostało w 49 szpitalach w 26 stanach spełniających kryteria włączenia do badania. 6627 pacjentów z 27 szpitali spełniło kryteria włączenia dla pacjentów i placówek w kohorcie MDC. Pacjentów do grupy MDC przydzielono metodą propensity score matching, jak opisano powyżej, 6627 pacjentów spełniałokryteria włączenia do badania, ale ich leczenie nie było koordynowane za pośrednictwem MDT. W kohorcie MDC 88% pacjentów (5832/6627) otrzymywało leczenie zalecane w wytycznych NCCN w porównaniu z 71% (4705/6627) w kohorcie nieleczonej w ramach MDT (P < 0,0001).12
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
AJCC, Amerykański Wspólny Komitet ds. Raka; OUN, ośrodkowy układ nerwowy; ctDNA, krążące DNA nowotworowe; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; IASLC, międzynarodowe Stowarzyszenie badań nad rakiem płuc; L858R, substytucja w eksonie 21; MDT, zespół multidyscyplinarny; NCCN®, National Comprehensive Cancer Network®; NDRP, niedrobnokomórkowy rak płuca; OR, iloraz szans; PD-L1, ligand receptora programowanej śmierci komórki 1; RT, radioterapia; T790M, mutacja w pozycji 790, w eksonie 20.
1. Pignon JP, Tribodet H, Scagliotti GV, et al; LACE Collaborative Group. Lung Adjuvant Cisplatin Evaluation: a pooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008;26(21):3552–3559.
2. Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: proposals for revision of the TNM stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer. J Thorac Oncol. 2016;11(1):39–51.
3. Galvez C, Jacob S, Finkelman BS, et al. The role of EGFR mutations in predicting recurrence in early and locally advanced lung adenocarcinoma following definitive therapy. Onkotarget. 2020;11(21):1953–1960.
4. Li L, Luo S, Lin H, et al. Correlation between EGFR mutation status and the incidence of brain metastases in patients with non-small cell lung cancer. J Thorac Dis. 2017;9(8):2510–2520.
5. L.E. Hendriks, K.M. Kerr, J. Menis, T.S. Mok, U. Nestle, A. Passaro, S. Peters, D. Planchard, E.F. Smit, B.J. Solomon, G. Veronesi, M. Reck, Oncogene-addicted metastatic non-small-cell lung cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up☆, Annals of Oncology, Volume 34, Issue 4, 2023, Pages 339-357, ISSN 0923-7534, https://doi.org/10.1016/j.annonc.2022.12.009
6. Cho JH, Zhou W, Choi Y-L, et al. Retrospective molecular epidemiology study of PD-L1 expression in patients with EGFR-mutant non-small cell lung cancer. Cancer Res Treat. 2018;50(1):95–102.
7. Cytowane za zgodą NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.5.2022. ©National Comprehensive Cancer Network, Inc. 2022. Wszystkie prawa zastrzeżone. Dostęp 26 września 2022 r. Aby przejrzeć najnowszą i kompletną wersję wytycznych, odwiedź stronę NCCN.org. NCCN nie udziela żadnych gwarancji dotyczących treści, ich użytkowania lub zastosowania oraz zrzeka się wszelkiej odpowiedzialności za ich zastosowanie lub użytkowanie w dowolny sposób.
8. Sholl LM, Aisner DL, Varella-Garcia M, et al; LCMC Investigators. Multi-institutional oncogenic driver mutation analysis in lung adenocarcinoma: The Lung Cancer Mutation Consortium experience. J Thorac Oncol. 2015;10(5):768–777.
9. Kris MG, Johnson BE, Berry LD, I in. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs. JAMA. 2014;311(19):1998–2006.
10. Zhang B, Niu X, Zhang Q, et al. Circulating tumor DNA detection is correlated to histologic types in patients with early-stage non-small-cell lung cancer. Lung Cancer. 2019;134:108-116.
11. Charakterystyka Produktu Leczniczego Tagrisso (dostęp: 05.2024).
12. Freeman RK, Ascioti AJ, Dake M, Mahidhara RS. The effects of a multidisciplinary care conference on the quality and cost of care for lung cancer patients. Ann Thorac Surg. 2015;100(5):1834–1838.
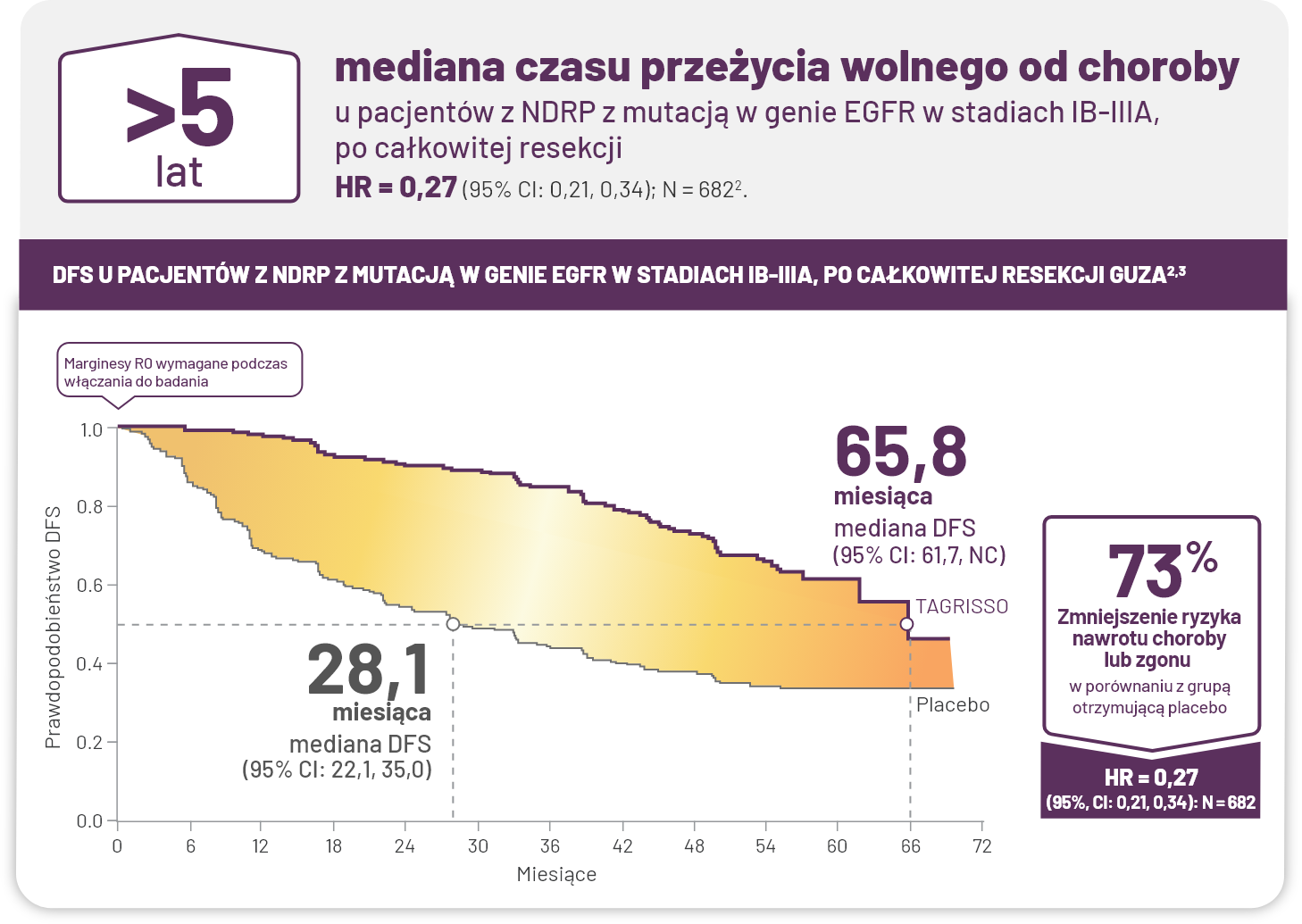
Skuteczność

W przypadku PACJENTA kwalifikującego się do RADYKALNEJ resekcji NDRP z mutacją w genie EGFR, NOWE DANE DOTYCZĄCE TAGRISSO potwierdzają, że to, co dotychczas było bezprecedensowe, jest możliwe.
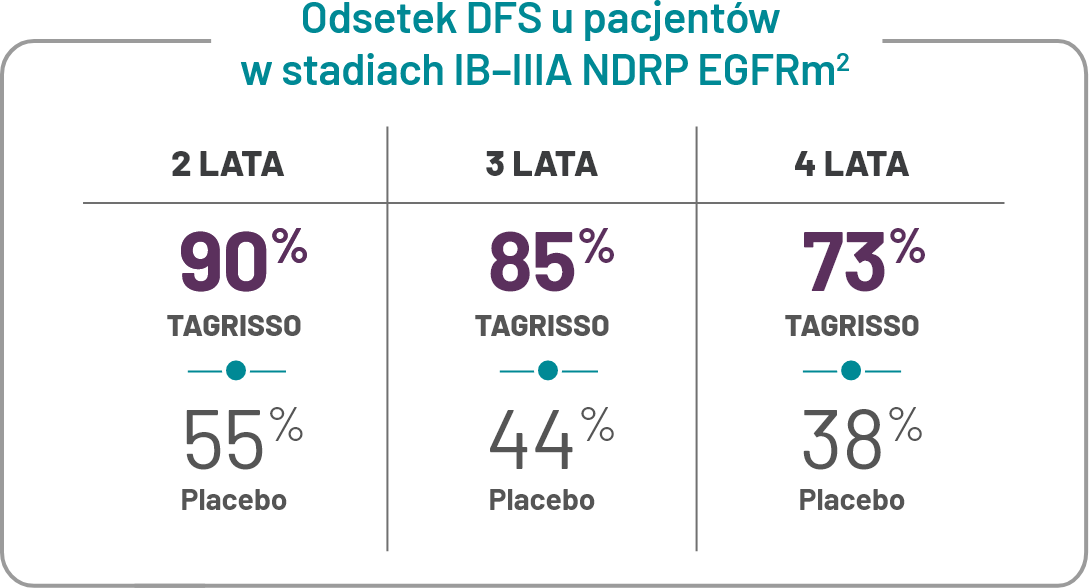
Mediana czasu całkowitej ekspozycji na leczenie wynosiła 35,8 miesiąca w grupie otrzymującej leczenie uzupełniające TAGRISSO i 25,1 miesiąca w grupie placebo2.
rekomendacje Polskie oraz międzynarodowe
Ozymertynib (TAGRISSO) to pierwsza i jedyna terapia IKT EGFR zalecana jako leczenie uzupełniające w stadiach zaawansowania IB-IIIA z mutacją EGFR po całkowitej resekcji guza4†§, i, ii, iii.
*Drugorzędowy punkt końcowy w analizie pośredniej. Pierwszorzędowym punktem końcowym był DFS u pacjentów po resekcji w stadium II– IIIA NDRP z mutacją EGFR. Mediana DFS nie została osiągnięta dla TAGRISSO (95% CI: 38,8, NE) i wynosiła 19,6 miesiąca (95% CI: 16,6, 24,5) dla grupy kontrolnej (HR = 0,17 [95% CI: 0,12, 0,23]; P<0,0001)1.
†Grupa kontrolna = placebo1.
iPassaro A, Leighl N, Blackhall F, et al. ESMO expert consensus statements on the management of EGFR mutant non- small-cell lung cancer. Ann Oncol. 2022;33(5):466-487.
iiLangfort R, Krzakowski M, Kowalski DM, Krenke R, Orłowski T, Rzyman W, Wasąg B. Expert opinion on adjuvant treatment with osimertinib in patients with non-small cell lung carcinoma after radical tumor resection. Oncol Clin Pract. DOI: 10.5603/OCP.2023.0018
iiiKrzakowski M, Jassem J, Antczak A et al. Thoracic neoplasms. Oncol Clin Pract. 2022; 18. DOI: 10.5603/OCP.2021.0022
Analiza podgrup
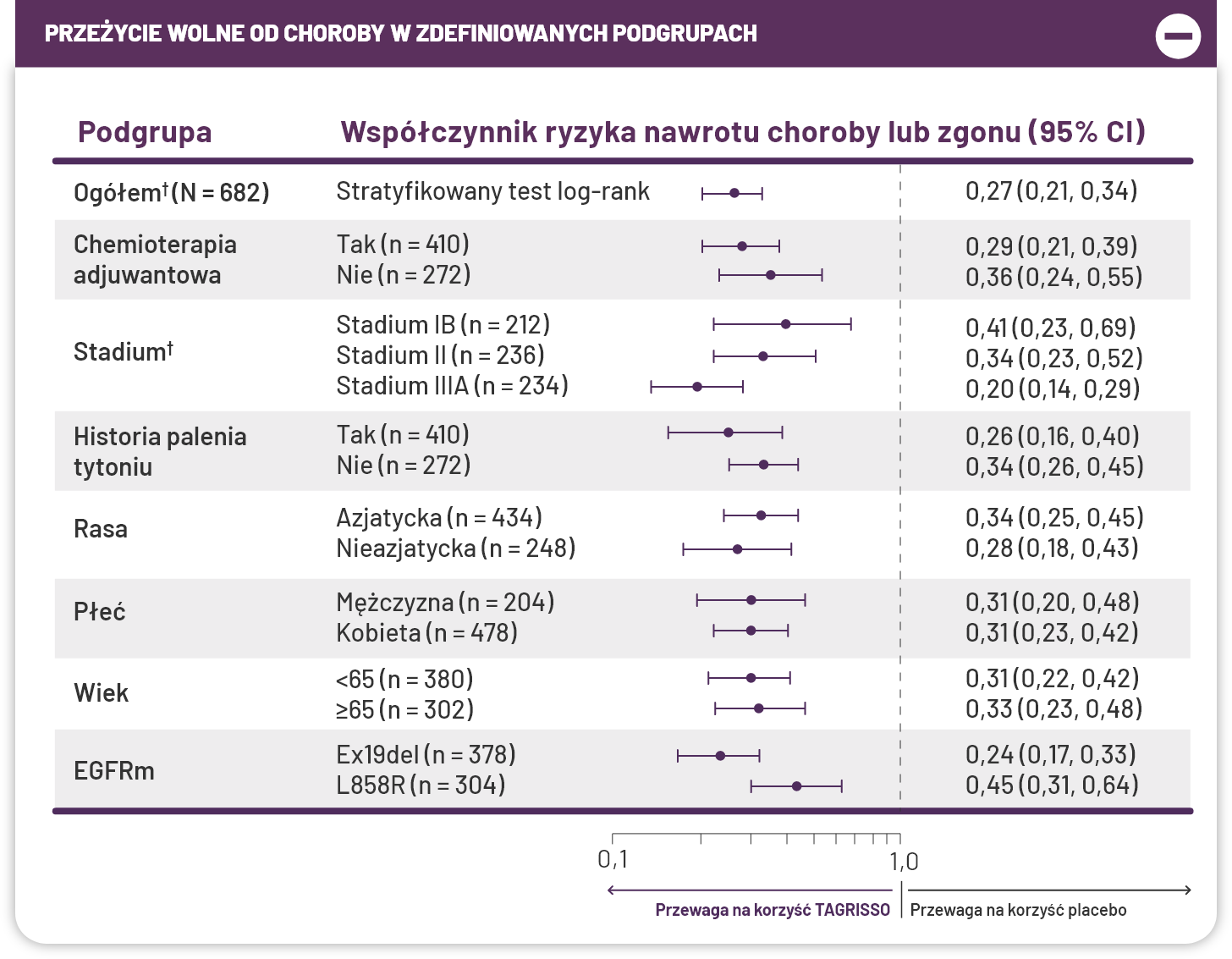
Stwierdzono zmniejszone ryzyko nawrotu lub zgonu we wszystkich wstępnie zdefiniowanych podgrupach2*
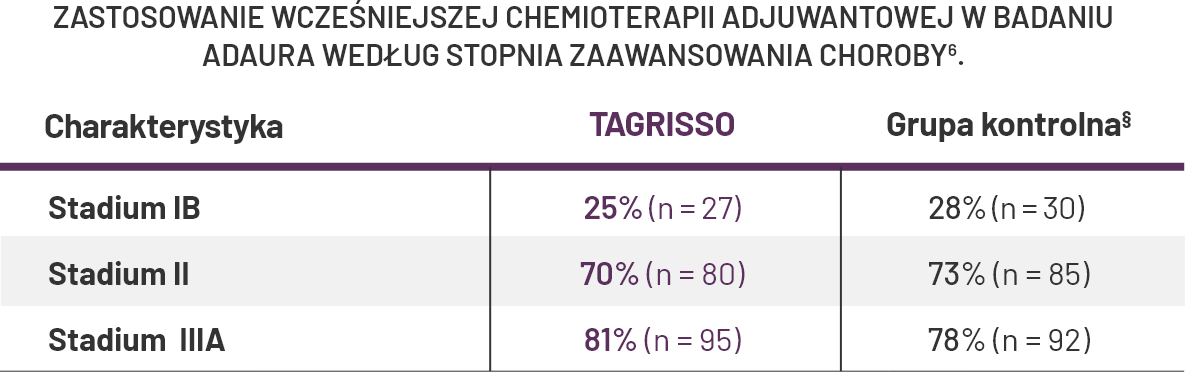
Decyzja o zastosowaniu chemioterapii adjuwantowej, zgodnie z protokołem badania ADAURA, należała do lekarza prowadzącego5.
TAGRISSO jest jedyną zarejestrowaną opcją leczenia adjuwantowego dla pacjentów z NDRP z mutacjami EGFR, kwalifikujących się do całkowitej resekcji guza1,3,7-10||.
Analiza eksploracyjna podgrup

Diagnostyka pod kątem mutacji EGFR wszystkich pacjentów kwalifikujących się do resekcji guza w celu wyboru optymalnej opcji terapuetycznej.
Spójne wyniki DFS niezależnie od wcześniejszego zastosowania chemioterapii adjuwantowej w stadium IB-IIIA, po radykalnej resekcji guza1,2¶#.

* Pośrednia analiza przy użyciu zaktualizowanych danych DFS w dniu odcięcia danych. Mediana obserwacji DFS u wszystkich pacjentów wynosiła 44,2 miesiąca dla TAGRISSO i 27,7 miesiąca dla placebo2.
†Stadium IB–IIIA.
‡AJCC wydanie 7.
§Grupa kontrolna = placebo.
||Lek TAGRISSO jest wskazany w leczeniu adjuwantowym po resekcji nowotworu u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP), u których stwierdzono delecję w eksonie 19 lub substytucję L858R eksonu 21 wykryte zwalidowaną metodą1.
¶Drugorzędowy punkt końcowy w zaktualizowanej analizie DFS (DFS u pacjentów w stadium IB-IIIA): HR = 0,27 (95% CI: 0,21, 0,34); N=6822.
#W badaniu ADAURA chemioterapia adjuwantowa była dozwolona, ale nie obowiązkowa; decyzja w tym zakresie była podejmowana przez lekarza i pacjenta przed włączeniem do badania5.
** Eksploracyjna analiza podgrup. W badaniu ADAURA, u pacjentów, którzy nie otrzymywali wcześniej chemioterapii adjuwantowej, odstęp pomiędzy zabiegiem chirurgicznym a terapią adjuwantową lekiem TAGRISSO wynosił do 10 tygodni1.
††W badaniu ADAURA pacjenci byli poddawani terapii adjuwantowej lekiem TAGRISSO przez okres do 3 lat lub do nawrotu choroby bądź wystąpienia nieakceptowalnej toksyczności1.
‡‡ Eksploracyjna analiza podgrup. W badaniu ADAURA, u pacjentów, którzy otrzymywali wcześniej chemioterapię adjuwantową, odstęp pomiędzy zabiegiem chirurgicznym a terapią adjuwantową lekiem TAGRISSO wynosił do 26 tygodni1.
Dane dotyczące OUN

*OUN DFS była analizą post hoc opartą na zaktualizowanych danych DFS w dniu odcięcia po 4 latach.
†Mediana OUN DFS nie została osiągnięta (95% CI: 65,8, NC) dla grupy przyjmującej TAGRISSO ani (95% CI: NC, NC) dla grupy przyjmującej placebo2.
‡U 22 pacjentów z grupy otrzymującej TAGRISSO oraz u 41 pacjentów z grupy otrzymującej placebo doszło do nawrotu do OUN lub zgonu2.
Projekt badania ADAURA
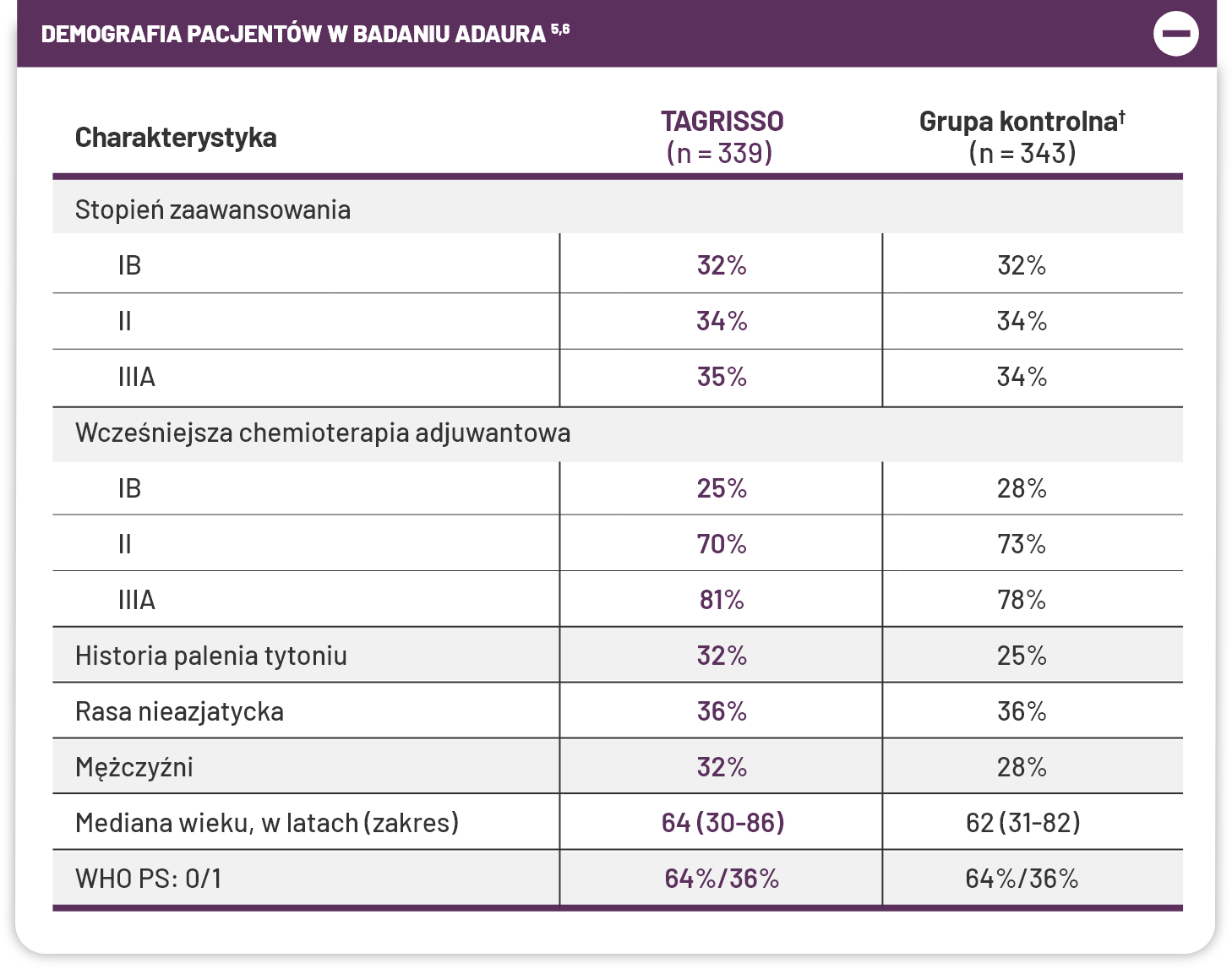
ADAURA: Badanie III fazy prowadzone metodą podwójnie ślepej próby po całkowitej resekcji guza w stadium IB-IIIA NDRP z mutacją EGFR1,5*†.
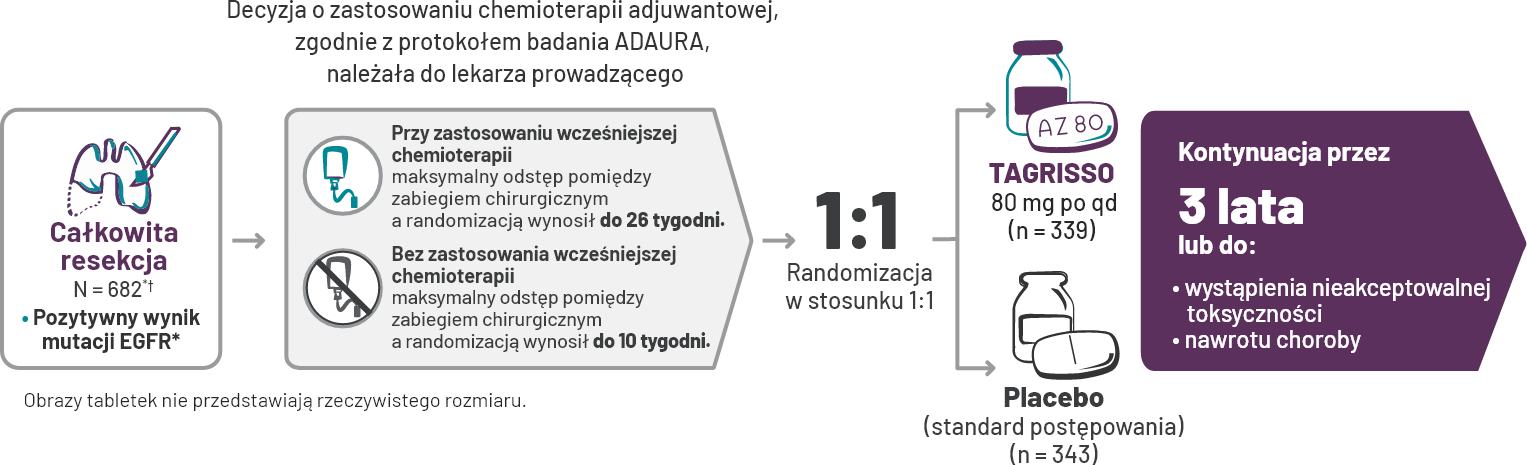
Do badania ADAURA włączono pacjentów z NDRP w stadiach IB-IIIA po resekcji całkowitej bez żadnych kryteriów wykluczających w zakresie rozmiaru guza (uwzględniono guzy wielkości >3 cm [T2aN0])1,3,7-10.

Zgodnie z rekomendacjami Niezależnej Komisji Centralnej, dane z badania ADAURA zostały opublikowane 2 lata wcześniej ze względu na skuteczność leczenia5.
*Do badania ADAURA zostali włączeni pacjenci z NDRP z mutacją EGFR (delecja w eksonie 19 lub mutacja w eksonie 21 z całkowicie usuniętym guzem w stadium IB, II i IIIA zdefiniowanym przez AJCC w wydaniu siódmym1.
†Pacjenci byli sklasyfikowani według stadium choroby (IB vs II vs IIIA), mutacji EGFR (delecja w eksonie 19 lub L858R) i rasy (azjatycka vs nieazjatycka)1.
Do badania ADAURA włączono pacjentów z NDRP w stadiach IB-IIIA po resekcji całkowitej bez żadnych kryteriów wykluczających w zakresie rozmiaru guza (uwzględniono guzy wielkości >3 cm [T2aN0])1,3,7-10.
rekomendacje Polskie oraz międzynarodowe
Cech kliniczno-patologicznych, takich jak: pochodzenie etniczne, palenie tytoniu, stan sprawności lub histologia NIE należy brać pod uwagę w celu selekcjonowania pacjentów z NDRP do badania w kierunku mutacji EGFR4, i, ii, iii.
Każdego pacjenta należy poddać badaniu na obecność mutacji w genie EGFR, niezależnie od fenotypu.
Każdy pacjent z NDRP z mutacją EGFR, kwalifikujący się do radykalnej resekcji guza, który może odnieść korzyści z leczenia adjuwantowego lekiem TAGRISSO, powinien być zdiagnozowany pod kątem obecności mutacji w genie EGFR.
Stopień zaawansowania
Badanie ADAURA obejmowało WSZYSTKICH pacjentów z NDRP po całkowitej resekcji guza, w stadiach IB-III, niezależnie od klasyfikacji AJCC wydanie 7. lub 8. Badanie nie przewidywało kryteriów wykluczających dotyczących wielkości guza (uwzględniono guzy wielkości >3 cm [T2aN0])1,3,7-10.
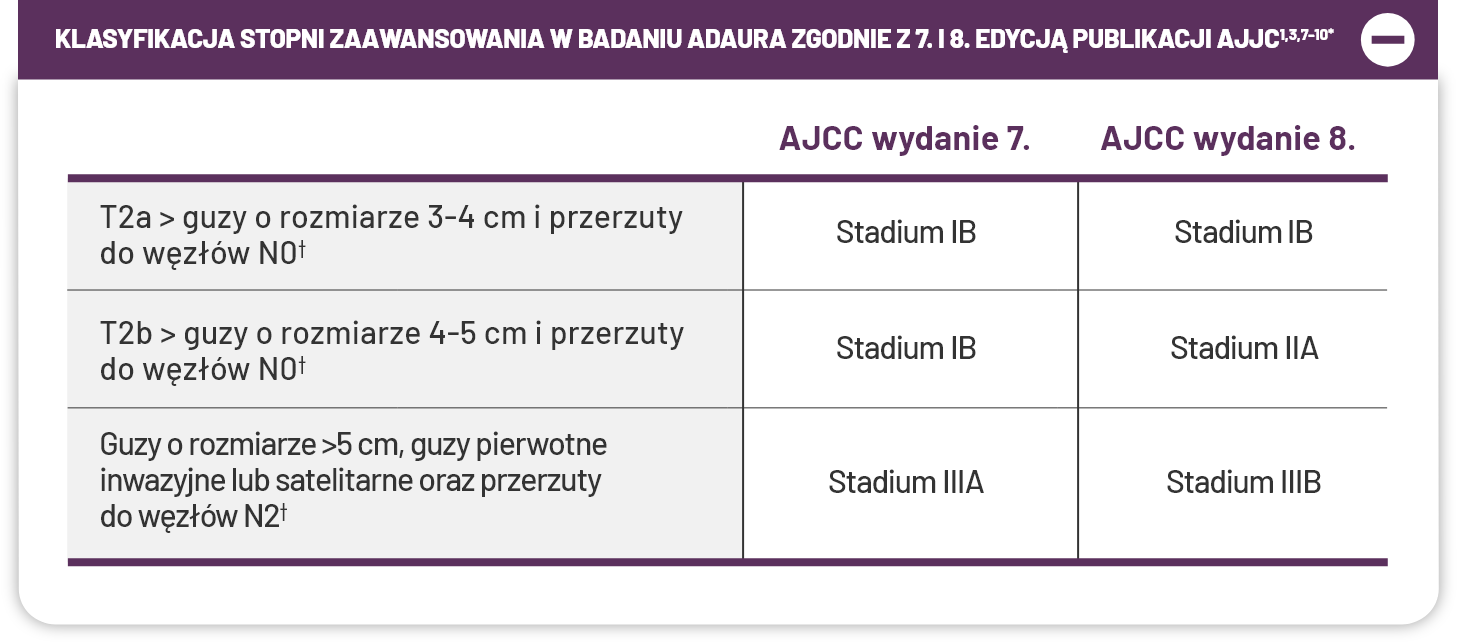
*Chociaż stadium choroby pacjentów w badaniu ADAURA zostało sklasyfikowane zgodnie z 7. wydaniem AJCC, wszyscy randomizowani pacjenci zostali również sklasyfikowani na początku badania zgodnie z 8. wydaniem AJCC3.
†Na podstawie aktualizacji 8. wydania AJCC niektórzy pacjenci pierwotnie sklasyfikowani do stadium IB w oparciu o 7. wydanie AJCC, nadal są sklasyfikowani do stadium IB, podczas gdy inni są sklasyfikowani do stadium IIA. Pacjenci w stadium IB z guzami o rozmiarze 3-4 cm > T2A i przerzutami do węzłów N0 są nadal sklasyfikowani do stadium IB. Pacjenci w stadium IB z guzami o rozmiarze T2B > 4-5 cm (dawniej T2A w oparciu o 7. wydanie AJCC) i przerzutami do węzłów N0 są obecnie sklasyfikowani do stadium IIA9,10.
‡Na podstawie aktualizacji 8. wydania AJCC niektórzy pacjenci sklasyfikowani do stadium IIIA w oparciu o 7. wydanie AJCC są obecnie sklasyfikowani do stadium IIIB. W 8. wydaniu AJCC stadium IIIB może odzwierciedlać przerzuty do węzłów N2, w tym N2 z guzami inwazyjnymi T3 lub N2 z guzami satelitarnymi T3. Do badania ADAURA zostali włączeni pacjenci w stadium IIIB, według aktualizacji 8. wydania AJCC9,10.
Analiza metod leczenia
Pomóż zapobiegać nawrotom: każdy pacjent z NDRP z mutacją EGFR w stadium IB- IIIA, który może odnieść korzyści z leczenia uzupełniającego lekiem TAGRISSO, powinien zostać zidentyfikowany.
rekomendacje Polskie oraz międzynarodowe
W wytycznych zaleca się przeprowadzenie diagnostyki molekularnej na obecność mutacji EGFR u pacjentów z NDRP kwalifikujących się do resekcji w stadiach IB-IIIA w celu podjęcia decyzji o odpowiednim leczeniu uzupełniającym4 *,i , ii, iii.
Ozymertynib (TAGRISSO) to pierwsza i jedyna terapia IKT stosowana jako leczenie uzupełniające NDRP IB-IIIA z EGFR po całkowitej resekcji guza4 *, i, ii, iii.
*Wytyczne NCCN dotyczące NDRP zawierają rekomendacje dotyczące niektórych pojedynczych biomarkerów, które powinny być testowane, i zalecają techniki testowania, ale nie wskazują żadnych konkretnych dostępnych na rynku testów biomarkerów ani laboratoriów komercyjnych4.
†Ozymertynib jest zalecany pacjentom z NDRP z mutacją EGFR (delecja w eksonie 19, L858R) w stadium zaawansowania IB-IIIA po całkowitej resekcji guza, niezależnie od wcześniejszego zastosowania chemioterapii uzupełniającej4.

Ponad połowa pacjentów z NDRP w stadium II-III nie otrzymuje leczenia po zabiegu chirurgicznym – należy rozważyć korzyści z leczenia uzupełniającego u pacjentów z NDRP z mutacją EGFR, kwalifikujących się do radykalnej resekcji11§.
REKOMENDACJA ASCO:
Należy stosować ozymertynib (TAGRISSO) w leczeniu NDRP z mutacją EGFR (delecja w eksonie 19, substytucją L858R w egzonie 21) w stadium IB (T > 3 cm) oraz po chemioterapii w stadium II-IIIA, niezależnie od ekspresji PD-L112.
‡Lub do czasu progresji choroby lub nieakceptowalnej toksyczności1.
§Badanie retrospektywne z udziałem 35134 pacjentów z nowotworem NDRP w stadium II lub III (AJCC wydanie 8) po resekcji guza zidentyfikowanych z krajowej bazy danych dotyczących raka w latach 2006-2012. Pacjenci, w przypadku których nie można było ustalić wcześniejszego zastosowania zabiegu chirurgicznego, chemioterapii lub radioterapii, czas chemioterapii był nieznany, podawano chemioterapię zarówno adjuwantową, jak i neoadjuwantową lub stosowano radioterapię, byli wykluczeni z badania. Spośród całkowitej populacji 18 684 pacjentów (53%) zostało poddanych zabiegowi chirurgicznemu w monoterapii; 1154 pacjentów (3%) zostało poddanych zabiegowi chirurgicznemu z zastosowaniem chemioterapii neoadjuwantowej; a 15 296 pacjentów (44%) zostało poddanych zabiegowi chirurgicznemu z zastosowaniem chemioterapii adjuwantowej11.
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
AJCC, Amerykański Wspólny Komitet ds. Raka; ASCO, Amerykańskie Towarzystwo Onkologii Klinicznej; CI, przedział ufności; OUN, ośrodkowy układ nerwowy; DFS, przeżycie wolne od choroby; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; ex19del, delecja eksonu 19; FDA, Amerykańska Agencja ds. Żywności i Leków; HR, współczynnik ryzyka; L858R, substytucja leucyny 858 argininą w eksonie 21; NC, niemożliwe do obliczenia; NCCN®, National Comprehensive Cancer Network®; NE, niemożliwe do oszacowania; NDRP, niedrobnokomórkowy rak płuc; PD-L1, ligand receptora programowanej śmierci 1; po, doustnie; PS, stan sprawności; QD, raz na dobę; QTc, odstęp QT skorygowany względem częstości akcji serca; QTcF, odstęp QT skorygowany metodą Fridericia; QoL, jakość życia; RT, radioterapia; TKI, inhibitor kinazy tyrozynowej; WHO, Światowa Organizacja Zdrowia.
1. Charakterystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024].
2. Tsuboi M, Wu YL, Grohe C, et al. Osimertinib as adjuvant therapy in patients with resected EGFRm stage IB–IIIA NSCLC: updated results from ADAURA. Przedstawiono podczas: Kongres ESMO 2022; 9–13 września 2022 r.; Paryż, Francja.
3. Wu YL, Tsuboi M, He J, et al; ADAURA Investigators. Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med. 2020;383(18):1711-1723 [protocol].
4. Cytowane za zgodą NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.5.2022. ©National Comprehensive Cancer Network, Inc. 2022. Wszystkie prawa zastrzeżone. Dostęp 26 września 2022 r. Aby przejrzeć najnowszą i kompletną wersję wytycznych, odwiedź stronę NCCN.org. NCCN nie udziela żadnych gwarancji dotyczących treści, ich użytkowania lub zastosowania oraz zrzeka się wszelkiej odpowiedzialności za ich zastosowanie lub użytkowanie w dowolny sposób.
5. Wu YL, Tsuboi M, He J, et al; ADAURA Investigators. Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med. 2020;383(18):1711-1723.
6. Wu YL, Tsuboi M, He J, et al; ADAURA Investigators. Osimertinib in resected EGFR-mutated non-small-cell lung cancer. N Engl J Med. 2020;383(18):1711-1723 [załącznik uzupełniający].
7. Koch AL, Vellanki PJ, Drezner N, i in. FDA approval summary: osimertinib for adjuvant treatment of surgically resected non-small cell lung cancer, a collaborative Project Orbis review. Clin Cancer Res. 2021;27(24):6638-6643.
8. Koch AL, Vellanki PJ, Drezner N, i in. FDA approval summary: osimertinib for adjuvant treatment of surgically resected non-small cell lung cancer, a collaborative Project Orbis review. Clin Cancer Res. 2021;27(24):6638-6643 [tabela uzupełniająca].
9. Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL, Trotti A III, eds. AJCC Cancer Staging Manual. 7th ed. New York, NY: Springer; 2010.
10. Rami-Porta R, Asamura H, Travis WD, Rusch VW. Lung cancer—major changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin. 2017;67(2):138-155.
11. MacLean M, Luo X, Wang S, Kernstine K, Gerber DE, Xie Y. Outcomes of neoadjuvant and adjuvant chemotherapy in stage 2 and 3 non-small cell lung cancer: an analysis of the National Cancer Database. Onkotarget. 2018;9(36):24470-24479.
12. Pisters K, Kris MG, Gaspar LE, Ismaila N; Adjuvant Systemic Therapy and Adjuvant Radiation Therapy for Stage I to IIIA NSCLC Guideline Expert Panel. Adjuvant systemic therapy and adjuvant radiation therapy for stage I-IIIA completely resected non-small-cell lung cancer: ASCO guideline rapid recommendation update. J Clin Oncol. 2022;40(10):1127-1129.
Profil bezpieczeństwa

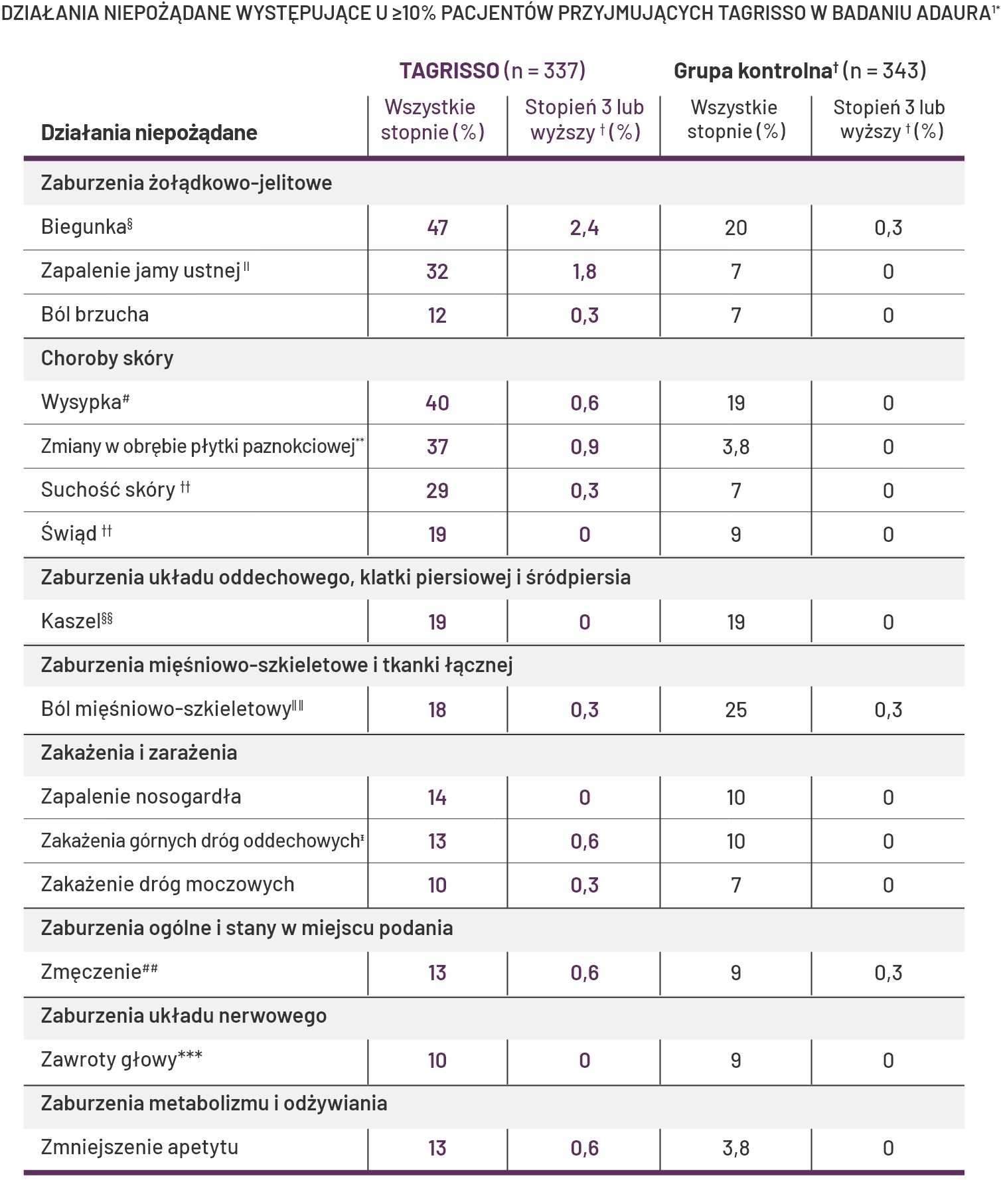
Wśród wyżej wymienionych działań niepożądanych nie zgłoszono działań niepożądanych stopnia 4 lub 5
związanych z terapią adjuwantową lekiem TAGRISSO lub placebo.
Klinicznie istotne działania niepożądane w badaniu ADAURA stwierdzono u <10% pacjentów przyjmujących
lek TAGRISSO. Obejmowały one: łysienie (6%), krwawienie z nosa (6%), śródmiąższową chorobę płuc (3%),
zespół erytrodyzestezji dłoniowo-podeszwowej (1,8%), pokrzywkę (1,5%), zapalenie rogówki (0,6%),
wydłużenie odstępu QTc (0,6%) oraz rumień wielopostaciowy (0,3%). Jako wydłużenie odstępu QTc
kwalifikowano częstość występowania wydłużenia odstępu QTcF > 500 ms1.
*NCI CTCAE v4.0.
†Grupa kontrolna = placebo.
‡Wszystkie zdarzenia sklasyfikowane jako zdarzenia stopnia 3.
§W tym biegunka, zapalenie jelita grubego, zapalenie jelita cienkiego.
||W tym afty, zapalenie czerwieni wargowej, owrzodzenie dziąseł, zapalenie języka, owrzodzenie języka, zapalenie jamy ustnej i owrzodzenie jamy ustnej.
¶W tym dyskomfort w jamie brzusznej, ból brzucha, ból w podbrzuszu, ból w nadbrzuszu, dyskomfort w nadbrzuszu, ból wątroby.
#W tym wysypka ogólna, wysypka rumieniowa, wysypka plamista, wysypka plamisto-grudkowa, wysypka grudkowa, wysypka swędząca, wysypka pęcherzykowa, rogowacenie okołomieszkowe, rumień, zapalenie mieszków włosowych, trądzik, zapalenie skóry, zmiany trądzikopodobne, pęcherzowe zapalenie skóry, złuszczające zapalenie skóry, wysypka polekowa, wyprysk, wyprysk asteatotyczny, liszaj płaski, nadżerki, krosty.
**W tym zmiany w obrębie łożyska paznokci, zapalenie łożyska paznokci, zakażenie łożyska paznokci, odbarwienie paznokci, pigmentacja paznokci, zmiany w obrębie płytki paznokciowej, dystrofia paznokci, zakażenie paznokci, bruzdy na paznokciach, ból w obrębie paznokci, łamliwość paznokci, onychomadeza, zmięknienie paznokci, zanokcica.
††W tym suchość, stwardnienie skóry, kseroza, wyprysk, skóra pergaminowata.
‡‡W tym świąd, świąd uogólniony, świąd powiek.
§§W tym kaszel, kaszel mokry, zespół kaszlowy górnych dróg oddechowych.
IIIIW tym ból stawów, zapalenie stawów, ból pleców, ból kości, ból mięśniowo-szkieletowy w klatce piersiowej, ból mięśniowo-szkieletowy, ból mięśni, ból szyi, ból w klatce piersiowej o etiologii niekardiologicznej, ból kończyn i ból kręgosłupa.
¶¶W tym zapalenie pęcherza moczowego, zakażenie dróg moczowych i bakteryjne zakażenie dróg moczowych.
##W tym astenia, zmęczenie.
***W tym zawroty głowy i położeniowe zawroty głowy.
†††Najczęstszymi działaniami niepożądanymi prowadzącymi do przerwania leczenia lekiem TAGRISSO były śródmiąższowa choroba płuc (2,7%) i wysypka (1,2%).
‡‡‡Najczęstszymi działaniami niepożądanymi prowadzącymi do zmniejszenia dawki lub przerwania leczenia były biegunka (4,5%), zapalenie jamy ustnej (3,9%), zmiany w obrębie płytki paznokciowej (1,8%) i wysypka (1,8%).
Odchylenia w wynikach badań laboratoryjnych
Terapia adjuwantowa lekiem TAGRISSO: większość odchyleń w wynikach badań laboratoryjnych w badaniu ADAURA występowała w stopniu 1 lub stopniu 214*.
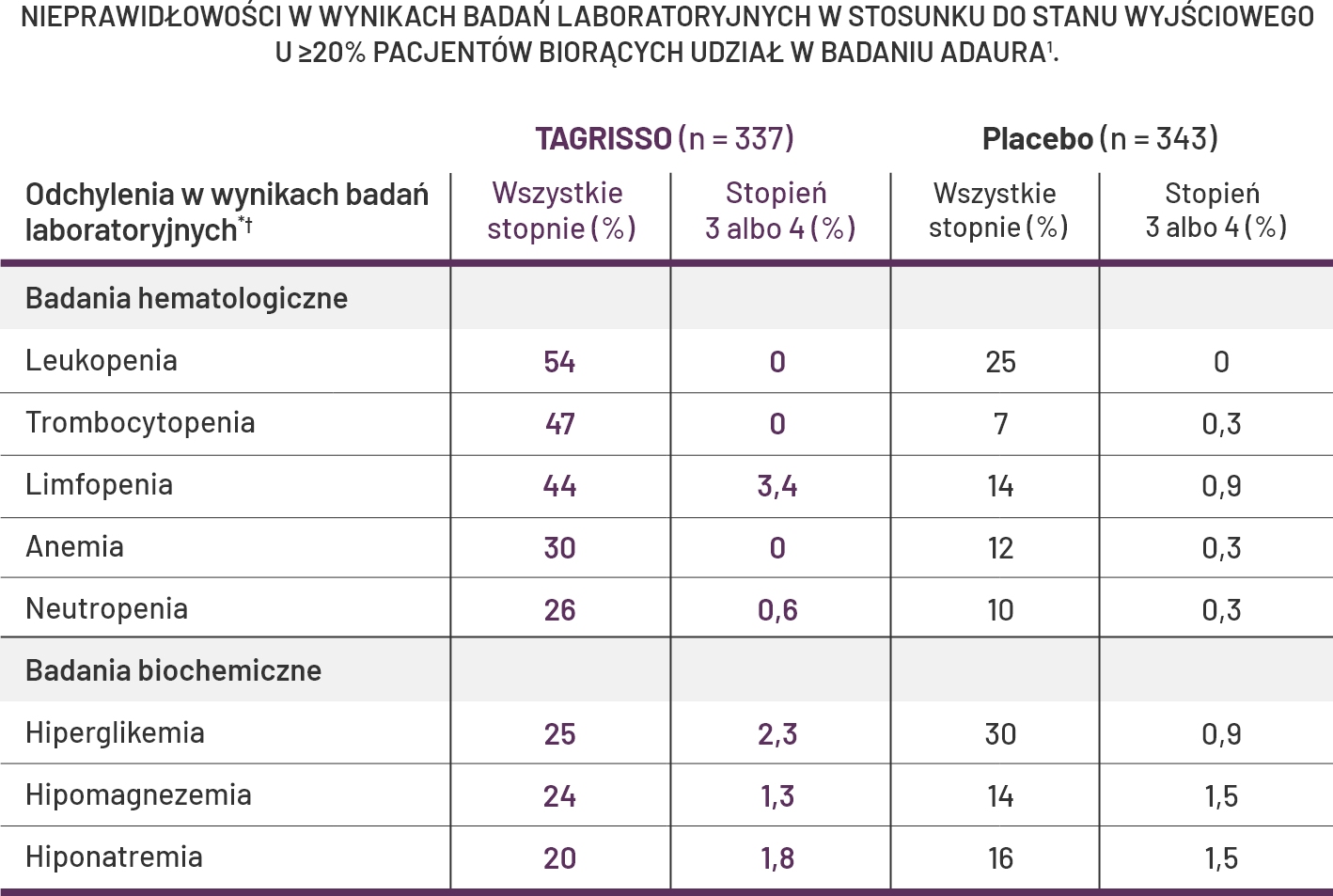
Odchylenia w wynikach badań laboratoryjnych w badaniu ADAURA, które wystąpiły u <20% pacjentów otrzymujących lek TAGRISSO, obejmowały zwiększenie stężenia kreatyniny we krwi (10%)1.
*NCI CTCAE v4.0.
†Na podstawie liczby pacjentów z dostępnymi danymi laboratoryjnymi z obserwacji kontrolnej.
‡Grupa kontrolna = placebo.
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
ARs, działania niepożądane; CTCAE, Stopień nasilenia klinicznych działań niepożądanych określany na podstawie Wspólnych kryteriów terminologicznych National Cancer Institute; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; NCI, Narodowy Instytut Onkologiczny; NDRP, niedrobnokomórkowy rak płuca; QTc, odstęp QT z uwzględnieniem czynności serca; QTcF, skorygowany odstęp QT metodą Fridericia.
1. Charakterystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024].
Dawkowanie


WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
1L, leczenie pierwszej linii; 2L, leczenie drugiej linii; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; L858R, substytucja leucyny 858 argininą w eksonie 21; mNDRP, niedrobnokomórkowy rak płuca z przerzutami; NG, nosożołądkowy; NDRP, niedrobnokomórkowy rak płuc; T790M, substytucja treoniny w metioninę w pozycji 790 w eksonie 20.
1. Charakterystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024]
Ocena mutacji w genie kodującym EGFR
Jeżeli rozważane jest zastosowanie produktu leczniczego TAGRISSO w leczeniu uzupełniającym po radykalnej resekcji guza u pacjentów z NDRP, potwierdzenie mutacji (delecja w egzonie 19 – Ex19del lub substytucji w egzonie 21 L858R) jest warunkiem koniecznym do inicjacji terapii ozymertynibem. Ocena obecności mutacji powinna zostać przeprowadzona w laboratoriach klinicznych z wykorzystaniem zwalidowanych testów na podstawie DNA z materiału histologicznego pozyskanego podczas biopsji lub z materiału pooperacyjnego. Jeżeli rozważane jest zastosowanie produktu leczniczego TAGRISSO w leczeniu miejscowo zaawansowanego lub uogólnionego NDRP, ważne jest, aby potwierdzona została obecność mutacji w genie kodującym EGFR. Oznaczenie należy wykonać przy użyciu walidowanej metody testowej z użyciem DNA pozyskanego z tkanki guza lub wolnego krążącego DNA nowotworowego (ctDNA) pozyskanego z osocza. Dodatni wynik oznaczenia statusu mutacji w genie kodującym EGFR (mutacje aktywujące w genie EGFR w przypadku leczenia pierwszego rzutu, mutacje delecji w eksonie 19 lub substytucji w eksonie 21 (L858R), gdy produkt leczniczy TAGRISSO jest podawany w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny w leczeniu pierwszego rzutu lub mutacje oporności T790M w przypadku progresji w trakcie lub po zakończonej terapii inhibitorami kinaz tyrozynowych) testem przeznaczonym do badania materiału z tkanki guza lub z próbki osocza wskazuje na to, że pacjent kwalifikuje się do leczenia produktem leczniczym TAGRISSO. Jednakże, w przypadku oznaczania mutacji na podstawie badania ctDNA z próbki osocza i uzyskania wyniku ujemnego zalecane jest, o ile tylko jest to możliwe, wykonanie testu z wykorzystaniem tkanki guza, ze względu na możliwość uzyskiwania wyników fałszywie ujemnych w badaniu z próbki osocza. Do oceny należy wykorzystać wyłącznie stabilne, wiarygodne i czułe testy o udowodnionej użyteczności w diagnostyce mutacji w genie kodującym EGFR. Śródmiąższowa choroba płuc (ang. ILD) U pacjentów leczonych produktem leczniczym TAGRISSO w ramach badań klinicznych obserwowano występowanie ciężkiej, zagrażającej życiu lub prowadzącej do zgonu śródmiąższowej choroby płuc (ang. Interstitial Lung Disease, ILD) lub reakcje podobne do ILD (np. zapalenie płuc). W większości przypadków poprawa lub całkowite ustąpienie tego stanu następowało po przerwaniu stosowania leku. Pacjenci, u których uprzednio występowała śródmiąższowa choroba płuc, lub lekopochodna ILD, lub popromienne zapalenie płuc wymagające leczenia steroidami oraz pacjenci z jakimikolwiek objawami klinicznie czynnej ILD byli wykluczani z udziału w badaniach klinicznych (patrz punkt 4.8 w ChPL). W badaniach klinicznych ADAURA, FLAURA, FLAURA2 i AURA występowanie śródmiąższowej choroby płuc (ILD) lub reakcji podobnych do ILD zgłaszano u 4,0% spośród 1813 pacjentów, którzy otrzymywali produkt leczniczy TAGRISSO w monoterapii. Odnotowano 7 zgonów w przypadku leczenia pacjentów z miejscowo zawansowanym i uogólnionym NDRP. Nie odnotowano żadnego zgonu w przypadku leczenia uzupełniającego ozymertynibem. Częstość występowania ILD wynosiła 11,2% wśród Japończyków, 2,3% wśród Azjatów niebędących Japończykami oraz 2,7% wśród pacjentów pochodzenia nieazjatyckiego (patrz punkt 4.8 w ChPL). W badaniu klinicznym FLAURA2 występowanie ILD lub reakcji podobnych do ILD zgłoszono u 3,3%, a przypadki śmiertelne u 0,4% (n=1) spośród 276 pacjentów, którzy otrzymywali produkt leczniczy TAGRISSO w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny. Częstość występowania ILD wynosiła 14,9% wśród Japończyków oraz 1,7% wśród pacjentów pochodzenia nieazjatyckiego; u żadnego spośród pacjentów pochodzenia azjatyckiego niebędących Japończykami nie wystąpiło zdarzenie ILD w grupie otrzymującej leczenie skojarzone w badaniu FLAURA2. Mediana czasu od podania pierwszej dawki do początku ILD lub reakcji podobnych do ILD wyniosła 161 dni. U wszystkich pacjentów, u których dojdzie do wystąpienia ostrych objawów i (lub) niewyjaśnionego nasilenia objawów ze strony układu oddechowego (np. duszności, kaszlu, gorączki), należy natychmiast wykonać badania w celu wykluczenia ILD. W trakcie tej diagnostyki należy wstrzymać stosowanie tego produktu leczniczego. W przypadku potwierdzenia rozpoznania śródmiąższowej choroby płuc należy zaprzestać stosowania produktu leczniczego TAGRISSO i wdrożyć odpowiednie postępowanie u pacjenta. Wznowienie podawania produktu leczniczego TAGRISSO należy rozważyć wyłącznie po dokładnym uwzględnieniu korzyści i ryzyka u danego pacjenta. Ciężkie skórne działania niepożądane (ang. severe cutaneous adverse reactions, SCARs) W związku z leczeniem produktem leczniczym TAGRISSO raportowano przypadki zespołu Stevensa-Johnsona (SJS) i toksycznej nekrolizy naskórka (TEN) z częstością występowania mieszczącą się odpowiednio w kategorii „rzadko” i „częstość nieznana”. Przed rozpoczęciem leczenia należy pouczyć pacjentów o przedmiotowych i podmiotowych objawach SJS i TEN. W razie wystąpienia objawów przedmiotowych i podmiotowych sugerujących SJS lub TEN, leczenie produktem TAGRISSO należy przerwać. W przypadku rozpoznania SJS lub TEN leczenie produktem TAGRISSO należy natychmiast zakończyć. Wydłużenie odstępu QTc U pacjentów leczonych produktem leczniczym TAGRISSO może wystąpić wydłużenie odstępu QTc. Wydłużenie odstępu QTc może prowadzić do zwiększenia ryzyka wystąpienia tachyarytmii komorowych (np. torsade de pointes) lub nagłego zgonu. W badaniach ADAURA, FLAURA, FLAURA2 i AURA nie zgłaszano występowania u pacjentów jakichkolwiek arytmii związanych z wydłużeniem odstępu QTc (patrz punkt 4.8 w ChPL). Pacjenci z klinicznie istotnymi zaburzeniami rytmu i przewodzenia stwierdzonymi na podstawie spoczynkowych zapisów elektrokardiograficznych (EKG) (np. z odstępem QTc powyżej 470 msec) byli wykluczeni z udziału w tych badaniach (patrz punkt 4.8 w ChPL). O ile to możliwe, należy unikać stosowania produktu leczniczego TAGRISSO u pacjentów z wrodzonym zespołem wydłużonego odstępu QT. Należy rozważyć okresowe monitorowanie z wykonywaniem zapisów elektrokardiograficznych (EKG) oraz oznaczeń stężeń elektrolitów u pacjentów z zastoinową niewydolnością serca, zaburzeniami gospodarki elektrolitowej, a także u tych pacjentów, którzy przyjmują produkty lecznicze, o których wiadomo, że wydłużają odstęp QTc. Należy wstrzymać stosowanie u pacjentów, u których dojdzie do wydłużenia odstępu QTc powyżej 500 ms w co najmniej 2 odrębnych badaniach EKG do czasu powrotu odstępu QTc do wartości mniejszej niż 481 ms lub do powrotu odstępu QTc do wartości wyjściowej, jeżeli odstęp QTc wynosi 481 ms lub więcej, a następnie należy wznowić stosowanie produktu leczniczego TAGRISSO w zmniejszonej dawce zgodnie z instrukcjami podanymi w Tabeli 1. Należy trwale zaprzestać stosowania produktu leczniczego TAGRISSO u pacjentów, u których nastąpi wydłużenie odstępu QTc w połączeniu z którymkolwiek spośród następujących zaburzeń: torsade de pointes, polimorficzny częstoskurcz komorowy, objawy ciężkich zaburzeń rytmu serca. Zmiany kurczliwości serca W badaniach klinicznych, u pacjentów leczonych lekiem TAGRISSO w monoterapii, u których wykonano pomiar frakcji wyrzutowej lewej komory serca (ang. LVEF) w warunkach wyjściowych oraz co najmniej jeden pomiar kontrolny, zmniejszenie LVEF o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50% występowały u 4,2% pacjentów (65/1557). U pacjentów z kardiologicznymi czynnikami ryzyka oraz z zaburzeniami, które mogą wpływać na LVEF, należy rozważyć prowadzenie monitorowania czynności serca, w tym pomiary LVEF w warunkach wyjściowych oraz w trakcie leczenia. U pacjentów, u których wystąpią istotne objawy przedmiotowe lub podmiotowe ze strony serca podczas leczenia, należy rozważyć prowadzenie monitorowania czynności serca, w tym pomiary LVEF. W przypadku kontrolowanego placebo badania ADAURA z zastosowaniem produktu leczniczego TAGRISSO w leczeniu uzupełniającym 1,5% (5/325) w grupie pacjentów otrzymujących ozymertynib oraz 1,5% (5/331) z grupy kontrolnej doświadczyło LVEF zmniejszenie frakcji wyrzutowej lewej komory (LVEF) o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50%. W badaniu FLAURA2 u 8,0% (21/262) pacjentów leczonych produktem TAGRISSO w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny, u których wykonano pomiar LVEF w warunkach wyjściowych oraz co najmniej jeden pomiar kontrolny wystąpiło zmniejszenie LVEF o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50%. Zapalenie rogówki zgłaszano u 0,6% (n=10) spośród 1813 pacjentów leczonych lekiem TAGRISSO w monoterapii w ramach badań ADAURA, FLAURA, FLAURA2 i AURA. Pacjenci z objawami przedmiotowymi i podmiotowymi wskazującymi na zapalenie rogówki, takimi jak ostre lub nasilające się: zapalenie oka, łzawienie, nadwrażliwość na światło, niewyraźne widzenie, ból oka i (lub) zaczerwienienie oka, powinni zostać niezwłocznie skierowani do lekarza okulisty (patrz punkt 4.2 Tabela 1 w ChPL). Niedokrwistość aplastyczna W związku z leczeniem produktem leczniczym TAGRISSO zgłaszano rzadkie przypadki niedokrwistości aplastycznej, w tym zdarzenia śmiertelne. Przed rozpoczęciem leczenia należy pacjentów pouczyć w zakresie przedmiotowych i podmiotowych objawów niedokrwistości aplastycznej, w tym między innymi utrzymującej się gorączki, powstawania wylewów podskórnych, krwawienia, bladości, zakażenia i uczucia zmęczenia. Jeśli wystąpią przedmiotowe i podmiotowe objawy sugerujące niedokrwistość aplastyczną, należy rozważyć ścisłe monitorowanie pacjenta i przerwanie lub zakończenie podawania produktu leczniczego TAGRISSO. Leczenie produktem TAGRISSO należy zakończyć u pacjentów z potwierdzoną niedokrwistością aplastyczną (patrz punkt 4.2 w ChPL). Wiek i masa ciała Pacjenci w podeszłym wieku (> 65 lat) lub pacjenci o niskiej masie ciała (<50 kg) mogą być narażeni na zwiększone ryzyko wystąpienia działań niepożądanych stopnia 3. lub wyższego. Zaleca się ścisłe monitorowanie tych pacjentów (patrz punkt 4.8 w ChPL). Sód Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) w tabletce, więc zasadniczo jest on „wolny od sodu”