Nowotwór Z PRZERZUTAMI

DIAGNOSTYKA W NDRP

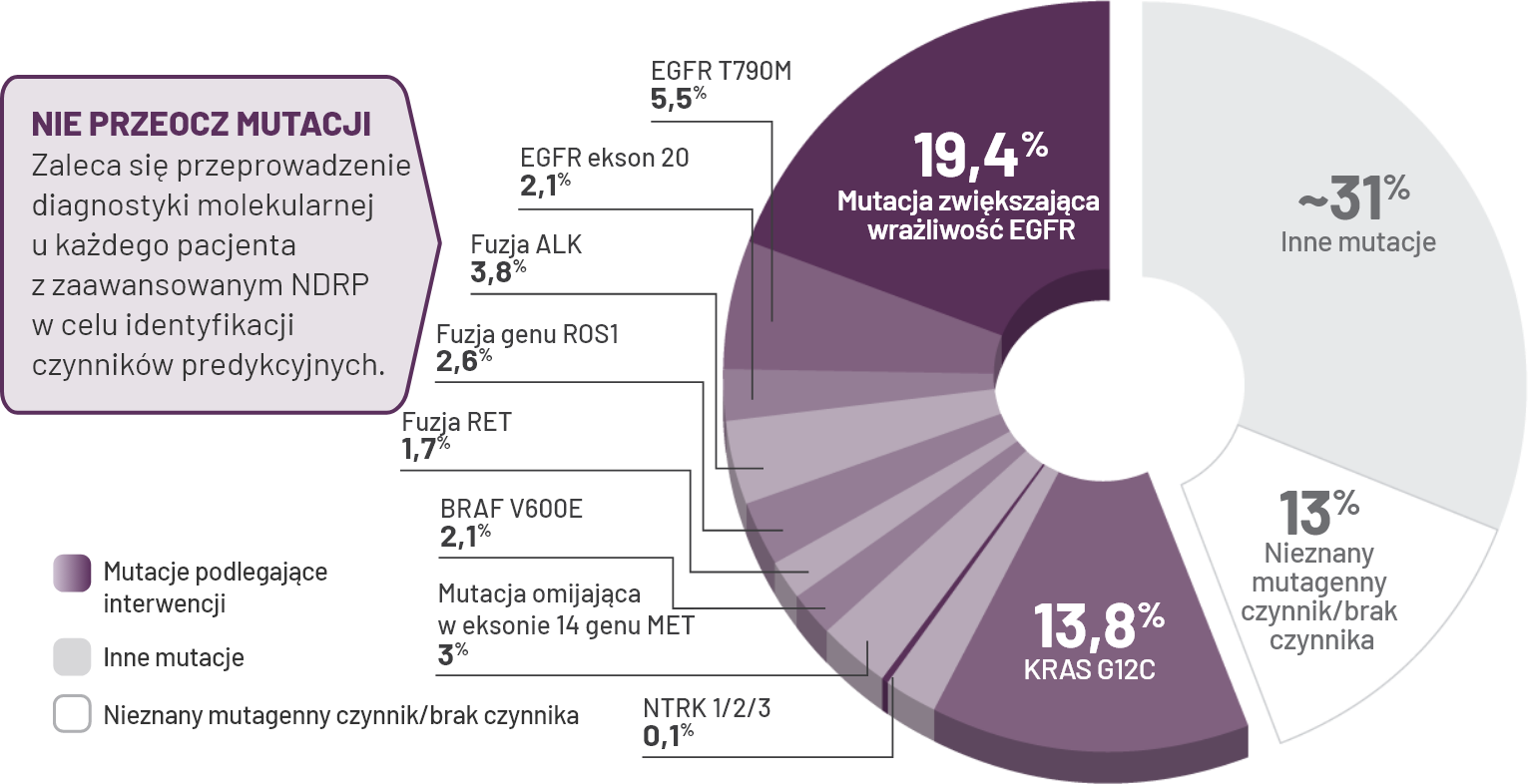
U ponad 50% pacjentów z zaawansowanym NDRP o histologii gruczolakoraka może występować mutacja aktywująca.
rekomendacje Polskie oraz międzynarodowe
Należy przeprowadzić diagnostykę pacjentów z zaawansowanym NDRP pod kątem zmian genetycznych, aby zidentyfikować punkty uchwytu leków ukierunkowanych molekularnie, jak również uniknąć terapii, w przypadku których prawdopodobieństwo korzyści klinicznych jest niskie4, i, ii, iii.
*Jordan i in. (2017) przeprowadzili prospektywną analizę 915 nowotworów u 860 pacjentów z nawracającym lub przerzutowym gruczolakorakiem płuc pod kątem mutacji w >300 genach związanych z rakiem przy użyciu testu Memborial Sloan Kettering-Integrated Mutation profilling of Actionable cancer targets (MSK-IMPACT), platformy sekwencjonowania nowej generacji opartej na wychwytywaniu hybrydyzacji1.
†Gatalica i in. (2019) dokonali przeglądu dużej grupy nowotworów litych wyprofilowanych przez komercyjne laboratorium, gdzie przetestowano je pod kątem fuzji genów NTRK oraz innych patogennych/docelowych zmian genomicznych i białkowych. Nie wskazano stadium zaawansowania choroby u badanych pacjentów. U 4073 chorych uczestniczących w badaniu występował niedrobnokomórkowy rak płuca o histologii gruczolakoraka, z czego u 4 pacjentów doszło do fuzji NTRK2.
‡Nassar i in. (2021) wyodrębnili dane z rejestru American Association for Cancer Research Project Genomics Evidence Neoplasia Information Exchange (GENIE) wersja 8.0 w celu zbadania rozmieszczenia mutacji KRAS u 32 138 pacjentów z nowotworami w zależności od rasy i płci. Mutacje KRAS zidentyfikowano w 1867 próbkach, najczęściej u pacjentów z NDRP (1443 z 10 444). U 76,3% pacjentów z NDRP stwierdzono histologię gruczolakoraka płuc. Nie wskazano stadium zaawansowania choroby u pacjentów3,5.
iPassaro A, Leighl N, Blackhall F, et al. ESMO expert consensus statements on the management of EGFR mutant non- small-cell lung cancer. Ann Oncol. 2022;33(5):466-487.
iiLangfort R, Krzakowski M, Kowalski DM, Krenke R, Orłowski T, Rzyman W, Wasąg B. Expert opinion on adjuvant treatment with osimertinib in patients with non-small cell lung carcinoma after radical tumor resection. Oncol Clin Pract. DOI: 10.5603/OCP.2023.0018
iiiKrzakowski M, Jassem J, Antczak A et al. Thoracic neoplasms. Oncol Clin Pract. 2022; 18. DOI: 10.5603/OCP.2021.0022
Kieruj na diagnostykę molekularną wszystkich pacjentów
Należy kierować na diagnostykę molekularną każdego pacjenta z zaawansowanym NDRP w celu kwalifikacji do optymalnej terapii.
Nie należy przewidywać statusu mutacji na podstawie historii palenia tytoniu, pochodzenia lub płci*.
rekomendacje Polskie oraz międzynarodowe
Wybierając pacjentów z zaawansowanym NDRP do badań pod kątem mutacji, NIE należy kierować się cechami, takimi jak pochodzenie etniczne, palenie tytoniu, stan pacjenta lub histologia4, i, ii, iii.
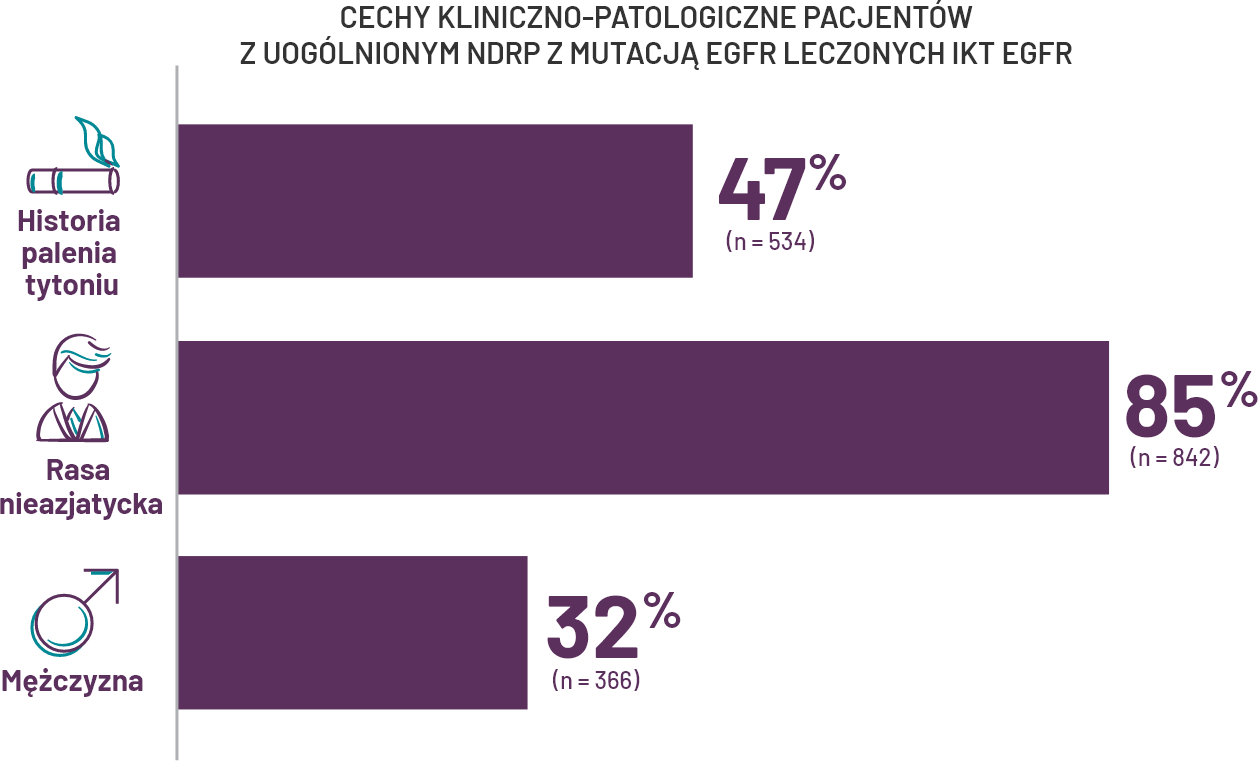
*Charakterystyka produktu leczniczego IKT EGFR z bazy danych Flatiron Health EHR. W badaniu uczestniczyło 1151 pacjentów, którzy rozpoczęli leczenie w okresie od 1 października 2017 r. do 30 kwietnia 2020 r.
†Obliczenia opierają się na pacjentach, w odniesieniu do których została określona rasa, a wykluczają z badania 157 chorych, u których tej cechy nie podano.
iPassaro A, Leighl N, Blackhall F, et al. ESMO expert consensus statements on the management of EGFR mutant non- small-cell lung cancer. Ann Oncol. 2022;33(5):466-487.
iiLangfort R, Krzakowski M, Kowalski DM, Krenke R, Orłowski T, Rzyman W, Wasąg B. Expert opinion on adjuvant treatment with osimertinib in patients with non-small cell lung carcinoma after radical tumor resection. Oncol Clin Pract. DOI: 10.5603/OCP.2023.0018
iiiKrzakowski M, Jassem J, Antczak A et al. Thoracic neoplasms. Oncol Clin Pract. 2022; 18. DOI: 10.5603/OCP.2021.0022
Potwierdź dokładną diagnozę przed leczeniem
W przypadku zaawansowanego NDRP z mutacją EGFR leczenie należy rozpocząć od terapii ukierunkowanej molekularnie zalecanej w wytycznych. Zastosowanie immunoterapii, a dopiero w dalszej kolejności leczenia IKT EGFR, może zaszkodzić pacjentom z zaawansowanym NDRP z mutacją EGFR*.

-
W 11 badaniach zastosowania immunoterapii jako leczenia pierwszej linii wykluczono chorych z NDRP z mutacją EGFR16-27§||.
*W 6 badaniach z udziałem 3867 pacjentów z NDRP i mutacjami w genie EGFR 394 chorych leczono immunoterapią, a następnie IKT EGFR. Działania niepożądane, w tym ILD, obserwowano przy sekwencyjnym stosowaniu immunoterapii, a następnie IKT EGFR - u pacjentów z mutacjami EGFR. Wzrost ryzyka toksyczności obserwowano głównie po zastosowaniu ozymertynibu6-11.
†Nie dotyczy pacjentów z mutacją insercji eksonu 2028.
‡Faza 2, jednoramienne badanie pembrolizumabu u pacjentów z zaawansowanym NDRP z EGFRm. 82% włączonych do badania chorych uprzednio nieleczonych przerwało leczenie z powodu braku skuteczności. Nie zaobserwowano odpowiedzi u 10 z 11 leczonych pacjentów, w tym nawet u pacjentów z ekspresją PD-L1 ≥ 50%. Po przeprowadzeniu powtórnej analizy stwierdzono odpowiedź u chorych z EGFR typu dzikiego15.
§W przypadku badań KEYNOTE-024, KEYNOTE-042, KEYNOTE-021 Kohorta G, KEYNOTE-189, CHECKMATE 026, CHECKMATE 227, CHECKMATE 9LA, IMpower110, IMpower130, IMpower132 i IMpower150 nie dopuszczono do badania pacjentów z uogólnionym NDRP z mutacjami EGFR, którzy nie byli wcześniej poddawani leczeniu. W badaniach IMpower130 i IMpower150 pacjenci z NDRP z EGFRm byli dopuszczeni do udziału w badaniu dopiero po progresji choroby po zastosowaniu terapii EGFR-IKT lub nietolerancji leczenia EGFR-IKT. Nie przeprowadzono bezpośrednich badań porównujących immunoterapię i terapię IKT EGFR u pacjentów z mNDRP z mutacją w genie EGFR16-27.
||Wykluczeni pacjenci z mNDRP mieli mutacje uwrażliwiające EGFR (delecje w eksonie 19 i mutacje L858R eksonu 21).
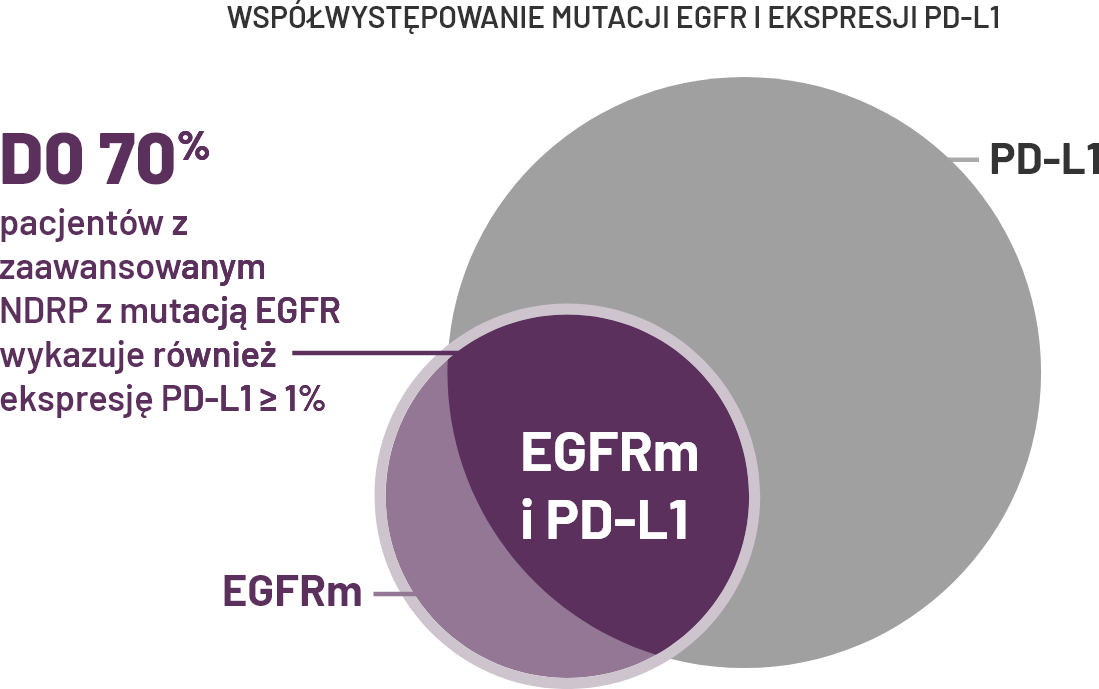
Dodatni wynik PD-L1 nie oznacza ujemnego wyniku w kierunku mutacji EGFR - ekspresja PD-L1 może występować u chorych mutacją EGFR.
rekomendacje Polskie oraz międzynarodowe
Najpierw należy przeprowadzić badanie molekularne.
U pacjentów z NDRP należy w pierwszej kolejności wykonać diagnostykę
w kierunku obecności mutacji, a następnie, przed rozpoczęciem leczenia inhibitorami immunologicznego punktu kontrolnego, oznaczyć stopień ekspresji PD–L14†#, i, ii, iii.
Terapia ukierunkowana molekularnie ma pierwszeństwo.
Leczenie ukierunkowane molekularnie powinno mieć pierwszeństwo przed leczeniem immunoterapią u pacjentów z zaawansowanym NDRP, nawet jeśli poziom ekspresji PD-L1 jest wysoki4, i, ii, iii.
#Wytyczne NCCN dotyczące NDRP zawierają rekomendacje dotyczące niektórych pojedynczych biomarkerów, które powinny być testowane, i zalecają techniki testowania, ale nie wskazują żadnych konkretnych dostępnych na rynku testów biomarkerów ani laboratoriów komercyjnych4.
iPassaro A, Leighl N, Blackhall F, et al. ESMO expert consensus statements on the management of EGFR mutant non- small-cell lung cancer. Ann Oncol. 2022;33(5):466-487.
iiLangfort R, Krzakowski M, Kowalski DM, Krenke R, Orłowski T, Rzyman W, Wasąg B. Expert opinion on adjuvant treatment with osimertinib in patients with non-small cell lung carcinoma after radical tumor resection. Oncol Clin Pract. DOI: 10.5603/OCP.2023.0018
iiiKrzakowski M, Jassem J, Antczak A et al. Thoracic neoplasms. Oncol Clin Pract. 2022; 18. DOI: 10.5603/OCP.2021.0022
W przypadku stwierdzenia mutacji EGFR należy rozpocząć leczenie ukierunkowane molekularnie zalecane w wytycznych**.
¶Mazieres i in. przeprowadzili wieloośrodkowe, międzynarodowe, retrospektywne badanie na grupie 551 chorych otrzymujących immunoterapię w monoterapii w zaawansowanym stadium NDRP z co najmniej jedną mutacją będącą czynnikiem onkogennym. 125 pacjentów miało mutację EGFR29. D’Incecco i in. przeprowadzili we Włoszech wieloośrodkowe, retrospektywne badanie oceniające ekspresję PD-L1 u 125 pacjentów z uogólnionym NDRP z mutacjami EGFR, translokacjami ALK lub mutacjami KRAS. 56 pacjentów miało mutację EGFR31. Dietel i in. przeprowadzili wieloośrodkowe, międzynarodowe badanie retrospektywne, w którym badano ekspresję PD-L1 w 2368 próbkach z potwierdzonym histologicznie pierwotnym NDRP w stadium IIIB/IV według klasyfikacji AJCC wydanie 7. U 448 pacjentów występowała mutacja EGFR32. Brown i in. analizowali ekspresję PD-L1 w 231 próbkach nieleczonego zaawansowanego NDRP z mutacją EGFR z badania FLAURA dotyczącego terapii ozymertynibem33.
**Mutacje w genie EGFR (delecja w eksonie 19 i substytucja L858R w eksonie 21).
Wykonanie badania
Należy przeprowadzić badanie na obecność mutacji w genie EGFR przed rozpoczęciem leczenia.
Dodatnie wyniki biopsji płynnej są wystarczające do wyboru odpowiedniego leczenia36.
Ujemne wyniki biopsji płynnej powinny być potwierdzone badaniem materiału tkankowego36.
*TAT dotyczy sekwencjonowania nowej generacji.
†Dane pochodzą z jednoośrodkowego prospektywnego badania kohortowego z udziałem 323 pacjentów z potwierdzonym histologicznie NDRP stadium IV, u których przeprowadzono badanie ctDNA w osoczu w ramach rutynowej praktyki klinicznej35.
‡U 5 z 22 (23%) chorych , u których nie udało się pobrać tkanki do biopsji, stwierdzono mutacje wyłącznie poprzez zastosowanie biopsji płynnej35.
§U 22 z 79 (28%) pacjentów, u których jakość/ilość tkanki nie była wystarczająca, mutacje stwierdzono poprzez zastosowanie biopsji płynnej35.
iPassaro A, Leighl N, Blackhall F, et al. ESMO expert consensus statements on the management of EGFR mutant non- small-cell lung cancer. Ann Oncol. 2022;33(5):466-487.
iiLangfort R, Krzakowski M, Kowalski DM, Krenke R, Orłowski T, Rzyman W, Wasąg B. Expert opinion on adjuvant treatment with osimertinib in patients with non-small cell lung carcinoma after radical tumor resection. Oncol Clin Pract. DOI: 10.5603/OCP.2023.0018
iiiKrzakowski M, Jassem J, Antczak A et al. Thoracic neoplasms. Oncol Clin Pract. 2022; 18. DOI: 10.5603/OCP.2021.0022
Rekomendacje NCCN

*Wytyczne NCCN dotyczące NDRP zawierają rekomendacje dotyczące niektórych pojedynczych biomarkerów, które powinny być testowane, i zalecają techniki testowania, ale nie wskazują żadnych konkretnych dostępnych na rynku testów biomarkerów ani laboratoriów komercyjnych4.
†Nie dotyczy pacjentów z mutacjami insercji w eksonie 20 genu EGFR28.
iPassaro A, Leighl N, Blackhall F, et al. ESMO expert consensus statements on the management of EGFR mutant non- small-cell lung cancer. Ann Oncol. 2022;33(5):466-487.
iiLangfort R, Krzakowski M, Kowalski DM, Krenke R, Orłowski T, Rzyman W, Wasąg B. Expert opinion on adjuvant treatment with osimertinib in patients with non-small cell lung carcinoma after radical tumor resection. Oncol Clin Pract. DOI: 10.5603/OCP.2023.0018
iiiKrzakowski M, Jassem J, Antczak A et al. Thoracic neoplasms. Oncol Clin Pract. 2022; 18. DOI: 10.5603/OCP.2021.0022
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
ALK, kinaza chłoniaka anaplastycznego; BRAF, homolog onkogenu wirusa mysiego mięsaka V Raf B1; ctDNA, krążące DNA nowotworowe; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, zmutowany receptor naskórkowego czynnika wzrostu; EHR, elektroniczna dokumentacja medyczna; G12C, mutacja G12C w genie KRAS; HER2, białkowy receptor dla czynnika wzrostu; ICI, inhibitor immunologicznych punktów kontrolnych; ILD, śródmiąższowa choroba płuc; IO, immunoterapia; KRAS, homolog wirusowego onkogenu szczurzego mięsaka Kirstena V-Ki-ras2; L858R, substytucja leucyny 858 argininą w eksonie 21; MDT, zespół multidyscyplinarny; MET, przejście mezenchymalno-epitelialne; mNDRP, niedrobnokomórkowy rak płuca z przerzutami; NDRP, niedrobnokomórkowy rak płuc; NTRK, receptory kinazy tyrozynowej; ORR, ogólny wskaźnik odpowiedzi; PD-L1, ligand receptora programowanej śmierci; QNS, ilość niewystarczająca; RET, przegrupowanie podczas transfekcji; ROS1, kinaza tyrozynowa protoonkogenu ROS1; T790M, substytucja metioniny w eksonie 20 treoniną 790; TAT, czas zwrotu; TKI, inhibitor kinazy tyrozynowej.
1. Jordan EJ, Kim HR, Arcila ME, I in. Prospective comprehensive molecular characterization of lung adenocarcinomas for efficient patient matching to approved and emerging therapies. Cancer Discov. 2017;7(6):596-609.
2. Gatalica Z, Xiu J, Swensen J, Vranic S. Molecular characterization of cancers with NTRK gene fusions. Mod Pathol. 2019;32(1):147-153.
3. Nassar AH, Adib E, Kwiatkowski DJ. Distribution of KRASG12C somatic mutations across race, sex, and cancer type [correspondence]. N Engl J Med. 2021;384(2):185-187.
4. Cytowane za zgodą NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.5.2022. ©National Comprehensive Cancer Network, Inc. 2022. Wszystkie prawa zastrzeżone. Dostęp 26 września 2022 r. Aby przejrzeć najnowszą i kompletną wersję wytycznych, odwiedź stronę NCCN.org. NCCN nie udziela żadnych gwarancji dotyczących treści, ich użytkowania lub zastosowania oraz zrzeka się wszelkiej odpowiedzialności za ich zastosowanie lub użytkowanie w dowolny sposób.
5. Nassar AH, Adib E, Kwiatkowski DJ. Distribution of KRASG12C somatic mutations across race, sex, and cancer type [correspondence]. N Engl J Med. 2021;384(2):185–187 [supplementary appendix 2].
6. Oshima Y, Tanimoto T, Yuji K, Tojo A. EGFR-TKI-associated interstitial pneumonitis in nivolumab-treated patients with non-small cell lung cancer. JAMA Oncol. 2018;4(8):1112-1115.
7. Schoenfeld AJ, Arbour KC, Rizvi H, et al. Severe immune-related adverse events are common with sequential PD-(L)1 blockade and osimertinib. Ann Oncol. 2019;30(5):839-844.
8. Ohe Y, Kato T, Shimizu W, et al. Real-world safety and efficacy data of osimertinib in patients from Japan with EGFR T790M-positive NSCLC. Przedstawiono podczas: Światowa konferencja IASLC poświęcona nowotworowi płuc; 7–10 września 2019 r.; Barcelona, Hiszpania.
9. Yamaguchi O, Kaira K, Kawasaki T, et al. Severe hepatotoxicity due to osimertinib after nivolumab therapy in patients with non-small cell lung cancer harboring EGFR mutation. Thorac Cancer. 2020;11(4):1045-1051.
10. Uchida T, Kaira K, Yamaguchi O, et al. Different incidence of interstitial lung disease according to different kinds of EGFR-tyrosine kinase inhibitors administered immediately before and/or after anti-PD-1 antibodies in lung cancer. Thorac Cancer. 2019;10(4):975-979.
11. Kotake M, Murakami H, Naito T, et al. Practical use of osimertinib in Japanese patients with EGFR T790M mutation positive advanced non-small-cell lung cancer [abstract]. Ann Oncol. 2016;27(suppl9):ix147.
12. Charakterystyka Produktu Leczniczego Keytruda
13. Charakterystyka Produktu Leczniczego Tecentriq
14. Charakterystyka Produktu Leczniczego Opdivo
15. Lisberg A, Cummings A, Goldman JW, et al. A phase II study of pembrolizumab in EGFR-mutant, PD-L1+, tyrosine kinase inhibitor naïve patients with advanced NSCLC. J Thorac Oncol. 2018;13(8):1138-1145.
16. Reck M, Rodríguez-Abreu D, Robinson AG, et al; KEYNOTE-024 Investigators. Pembrolizumab versus chemotherapy for PD-L1–positive non-small-cell lung cancer. N Engl J Med. 2016;375(19):1823-1833.
17. Clinicaltrials.gov. Study of MK-3475 (pembrolizumab) versus platinum-based chemotherapy for participants with PD-L1-positive advanced or metastatic non-small cell lung cancer (MK-3475-042/KEYNOTE-042). https://clinicaltrials.gov/ct2/show/NCT02220894. Dostęp 01 lipca 2020 r.
18. Langer CJ, Gadgeel SM, Borghaei H, et al; KEYNOTE-021 Investigators. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2 cohort of the open-label KEYNOTE-021 study. Lancet Oncol. 2016;17(11):1497-1508.
19. Broderick JM. Frontline pembrolizumab combo improves survival in phase III NSCLC trial. https://www.onclive.com/web-exclusives/frontline-pembrolizumab-combo-improves-survival-in-phase-iii-nsclc-trial. Opublikowano 16 stycznia 2018 r. Dostęp 20 listopada 2020 r.
20. Carbone DP, Reck M, Paz-Ares L, et al; CheckMate 026 Investigators. First-line nivolumab in stage IV or recurrent non–small-cell lung cancer. N Engl J Med. 2017;376(25):2415-2426.
21. Hellmann MD, Ciuleanu TE, Pluzanski A, et al. Nivolumab plus ipilimumab in lung cancer with a high tumor mutational burden. N Engl J Med. 2018;378(22):2093-2104.
22. Clinicaltrials.gov. A study of nivolumab and ipilimumab combined with chemotherapy compared to chemotherapy alone in first line NSCLC (CheckMate 9LA). https://clinicaltrials.gov/ct2/show/NCT03215706. Dostęp 30 września 2020 r.
23. Unijny rejestr badań klinicznych. A phase III multicenter, randomized, open-label study evaluating the efficacy and safety of atezolizumab (MPDL3280A, anti-PD-L1 antibody) in combination with carboplatin+nab-paclitaxel for chemotherapy-naive patients with stage IV non-squamous non-small cell lung cancer. EudraCT number 2014-003206-32.
24. Kowanetz M, Socinski MA, Zou W, et al. IMpower150: efficacy of atezolizumab plus bevacizumab and chemotherapy across PD-L1 expression subgroups defined by the SP142 and SP263 IHC assays confirm all-comer benefit in 1L metastatic NSCLC. Przedstawiono podczas: AACR; 14-18 kwietnia 2018 r.; Chicago, IL.
25. Papadimitrakopoulou VA, Cobo M, Bordoni R, et al. IMpower132: PFS and safety results with 1L atezolizumab + carboplatin/cisplatin + pemetrexed in stage IV non-squamous NSCLC [oral presentation]. Przedstawiono podczas: IASLC WCLC; 23–26 września 2018 r.; Toronto, Kanada.
26. Spigel D, de Marinis F, Giaccone G, et al. IMpower110: interim overall survival (OS) analysis of a phase III study of atezolizumab (atezo) vs platinum-based chemotherapy (chemo) as first-line (1L) treatment (tx) in PD-L1–selected NSCLC. Przedstawiono podczas: Europejskie Stowarzyszenie Onkologii Medycznej; 27–1 października 2019 r.; Barcelona, Hiszpania. Streszczenie LBA78.
27. Clinicaltrials.gov. A study of atezolizumab (MPDL3280A) compared with a platinum agent (cisplatin or carboplatin) + (pemetrexed or gemcitabine) in participants with stage IV non-squamous or squamous non-small cell lung cancer (NSCLC) [IMpower110]. https://clinicaltrials.gov/ct2/show/NCT02409342. Dostęp 01 lipca 2020 r.
28. Charakterystyka Produktu Leczniczego Rybrevant
29. Mazieres J, Drilon A, Lusque A, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol. 2019;30(8):1321-1328.
30. Mazieres J, Drilon A, Lusque A, et al. Immune checkpoint inhibitors for patients with advanced lung cancer and oncogenic driver alterations: results from the IMMUNOTARGET registry. Ann Oncol. 2019;30(8):1321-1328 [supplemental table].
31. D’Incecco A, Andreozzi M, Ludovini V, et al. PD-1 and PD-L1 expression in molecularly selected non-small-cell lung cancer patients. Br J Cancer. 2015;112(1):95-102.
32. Dietel M, Savelov N, Salanova R, et al. Real-world prevalence of programmed death ligand 1 expression in locally advanced or metastatic non–small-cell lung cancer: the global, multicenter EXPRESS study. Lung Cancer. 2019;134:174-179.
33. Brown H, Vansteenkiste J, Nakagawa K, et al. Programmed cell death ligand 1 expression in untreated EGFR mutated advanced NSCLC and response to osimertinib versus comparator in FLAURA. J Thorac Oncol. 2020;15(1):138-143.
34. Leighl NB, Page RD, Raymond VM, et al. Clinical utility of comprehensive cell-free DNA analysis to identify genomic biomarkers in patients with newly diagnosed metastatic non-small cell lung cancer. Clin Cancer Res. 2019;25(15):4691-4700.
35. Aggarwal C, Thompson JC, Black TA, et al. Clinical implications of plasma-based genotyping with the delivery of personalized therapy in metastatic non-small cell lung cancer. JAMA Oncol. 2019;5(2):173-180.
36. Merker JD, Oxnard GR, Compton C, et al. Circulating tumor DNA analysis in patients with cancer: American Society of Clinical Oncology and College of American Pathologists joint review. J Clin Oncol. 2018;36(16):1631–1641.
Skuteczność

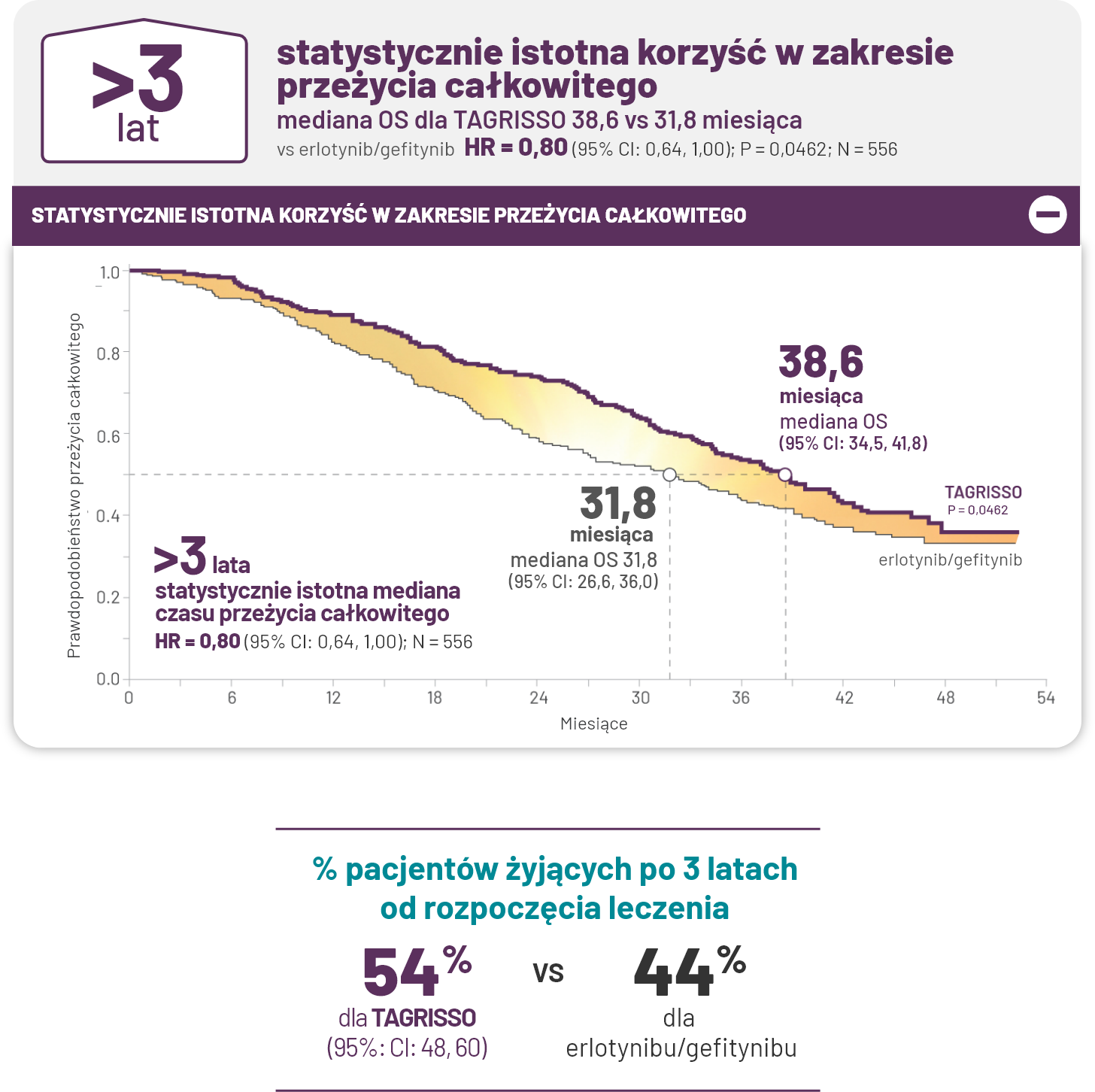
TAGRISSO w pierwszej linii leczenia: jedyna terapia z medianą całkowitego przeżycia dłuższą niż 3 lata.
Zastosowanie TAGRISSO wydłużyło medianę całkowitego przeżycia o prawie 7 miesięcy w porównaniu z terapią erlotynibem/gefitynibem1.
†Szczegółowe rekomendacje, w tym inne opcje leczenia, znajdują się w wytycznych NCCN3.
iPassaro A, Leighl N, Blackhall F, et al. ESMO expert consensus statements on the management of EGFR mutant non- small-cell lung cancer. Ann Oncol. 2022;33(5):466-487.
iiLangfort R, Krzakowski M, Kowalski DM, Krenke R, Orłowski T, Rzyman W, Wasąg B. Expert opinion on adjuvant treatment with osimertinib in patients with non-small cell lung carcinoma after radical tumor resection. Oncol Clin Pract. DOI: 10.5603/OCP.2023.0018
iiiKrzakowski M, Jassem J, Antczak A et al. Thoracic neoplasms. Oncol Clin Pract. 2022; 18. DOI: 10.5603/OCP.2021.0022
*Drugorzędowy punkt końcowy1.
U pacjentów otrzymujących erlotynib/gefitynib przy potwierdzonej progresji, w przypadku występowania mutacji oporności T790M, było dozwolone leczenie lekiem TAGRISSO. 65% (n = 180) pacjentów z grupy otrzymującej erlotynib i gefitynib otrzymało terapię 2 linii, z czego 47% (n = 85) leczenie lekiem TAGRISSO2,4.
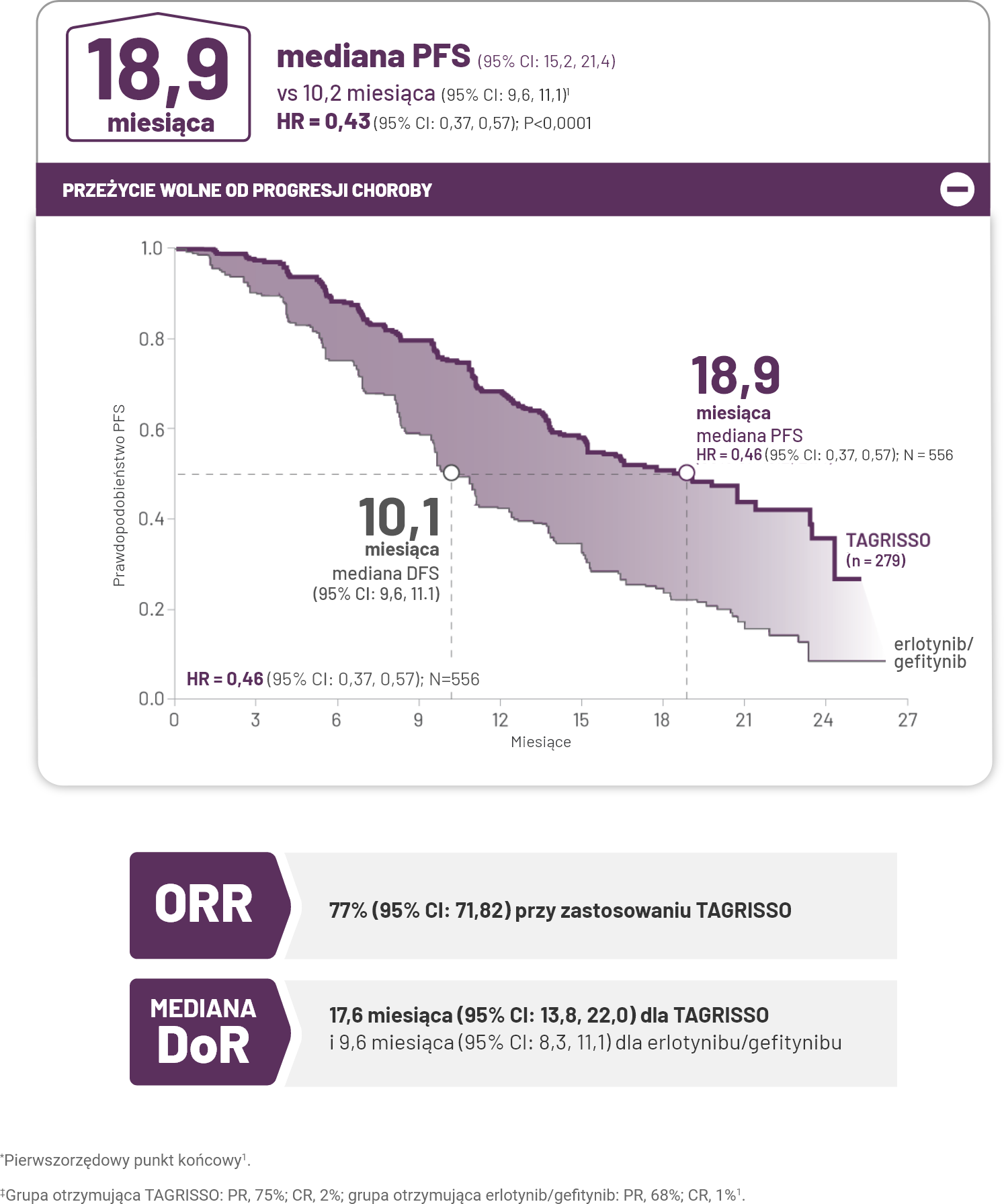
PFS
Podwojona mediana PFS, wynosząca 18,9 miesiąca w porównaniu z erlotynibem/gefitynibem.
Spadek ryzyka progresji lub zgonu o 54% w porównaniu z erlotynibem/gefitynibem1.
Podgrupy
TAGRISSO w pierwszej linii leczenia: spójne wyniki PFS we wszystkich grupach pacjentów.
Lek TAGRISSO zmniejszał ryzyko progresji lub zgonu we wszystkich wstępnie zdefiniowanych podgrupach4*.
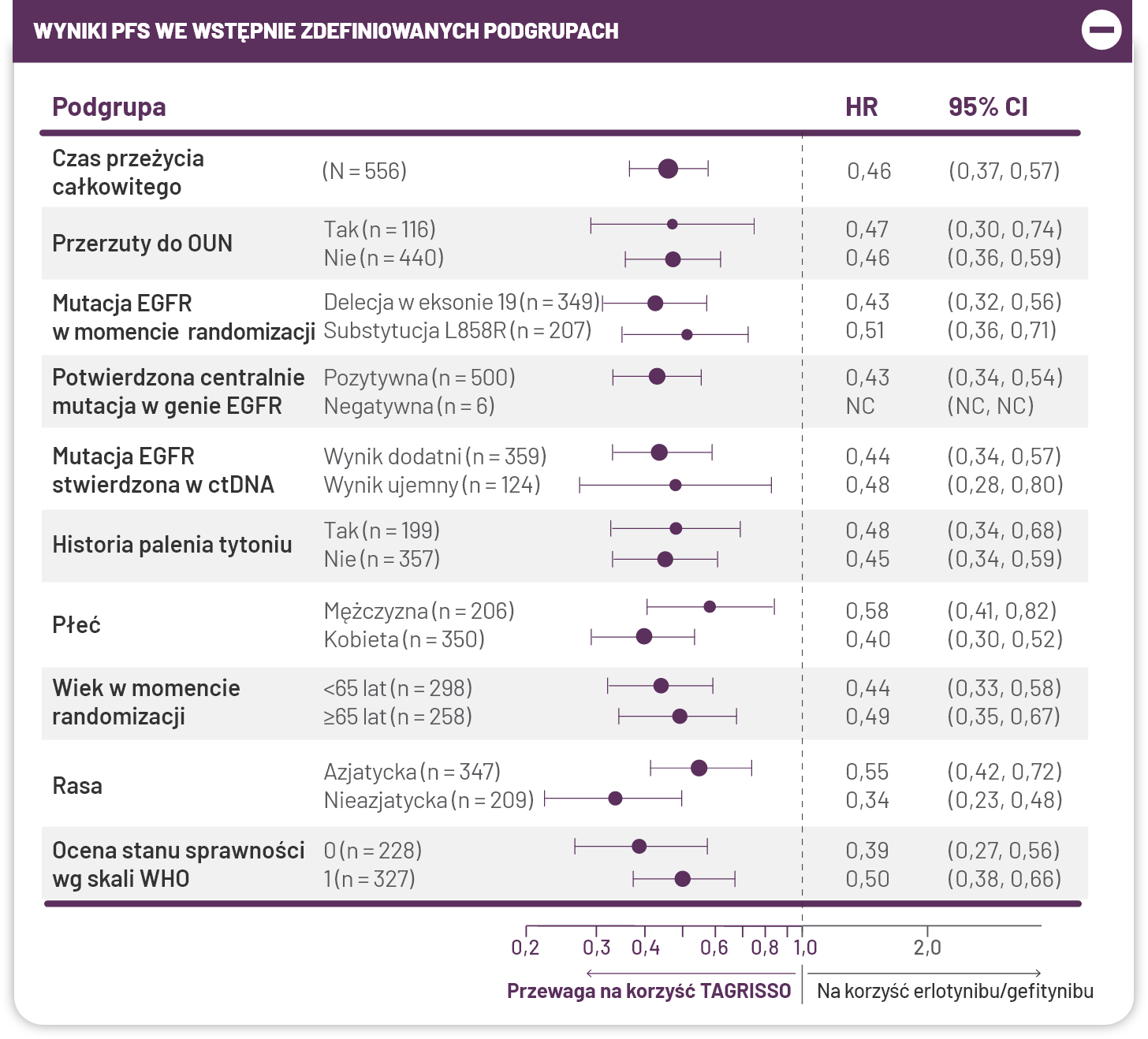
*Analiza eksploracyjna4.
†Wszyscy pacjenci* mieli wynik dodatni EGFR w badaniu materiału tkankowego4.
Na podstawie: Soria JC et al. N Engl J Med. 2018.
Dane dotyczące OUN
Przerzuty do OUN stanowią krytyczne zagrożenie w zaawansowanym NDRP z mutacją EGFR: 2 razy większe ryzyko w porównaniu z EGFR typu dzikiego (OR = 1,99)6*.

-
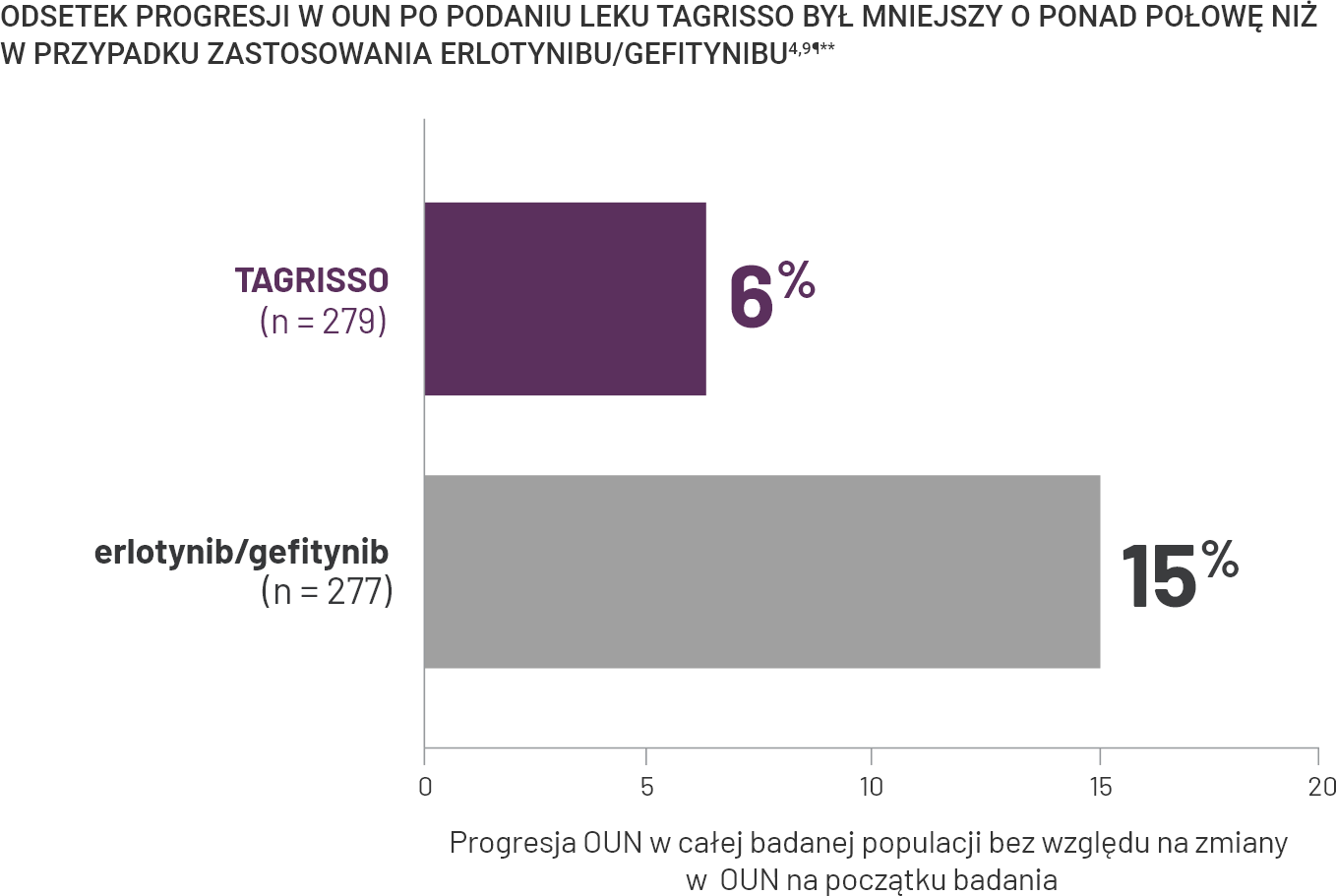
Mediana PFS OUN nie została osiągnięta podczas leczenia 1. linii produktem TAGRISSO (95% CI: 16,5, NC) vs 13,9 miesiąca (95% CI: 8,3, NZ) dla erlotynibu/gefitynibu8.
*Na podstawie metaanalizy, w ramach której zbadano częstość występowania przerzutów do OUN w NDRP z EGFRm lub EGFR typu dzikiego. Przeanalizowano dane 8152 pacjentów z 22 badań międzynarodowych. 16 z nich dotyczyło chorych w IV stadium zaawansowania. U 2664 pacjentów stwierdzono mutację w genie EGFR6.
†W oparciu o retrospektywne badanie amerykańskie, w którym oceniano częstość występowania przerzutów w OUN u 381 pacjentów z zaawansowanym NDRP - 86 z nich miało mutację EGFR7.
‡Wyniki PFS OUN uwzględniają jedynie progresję do OUN.
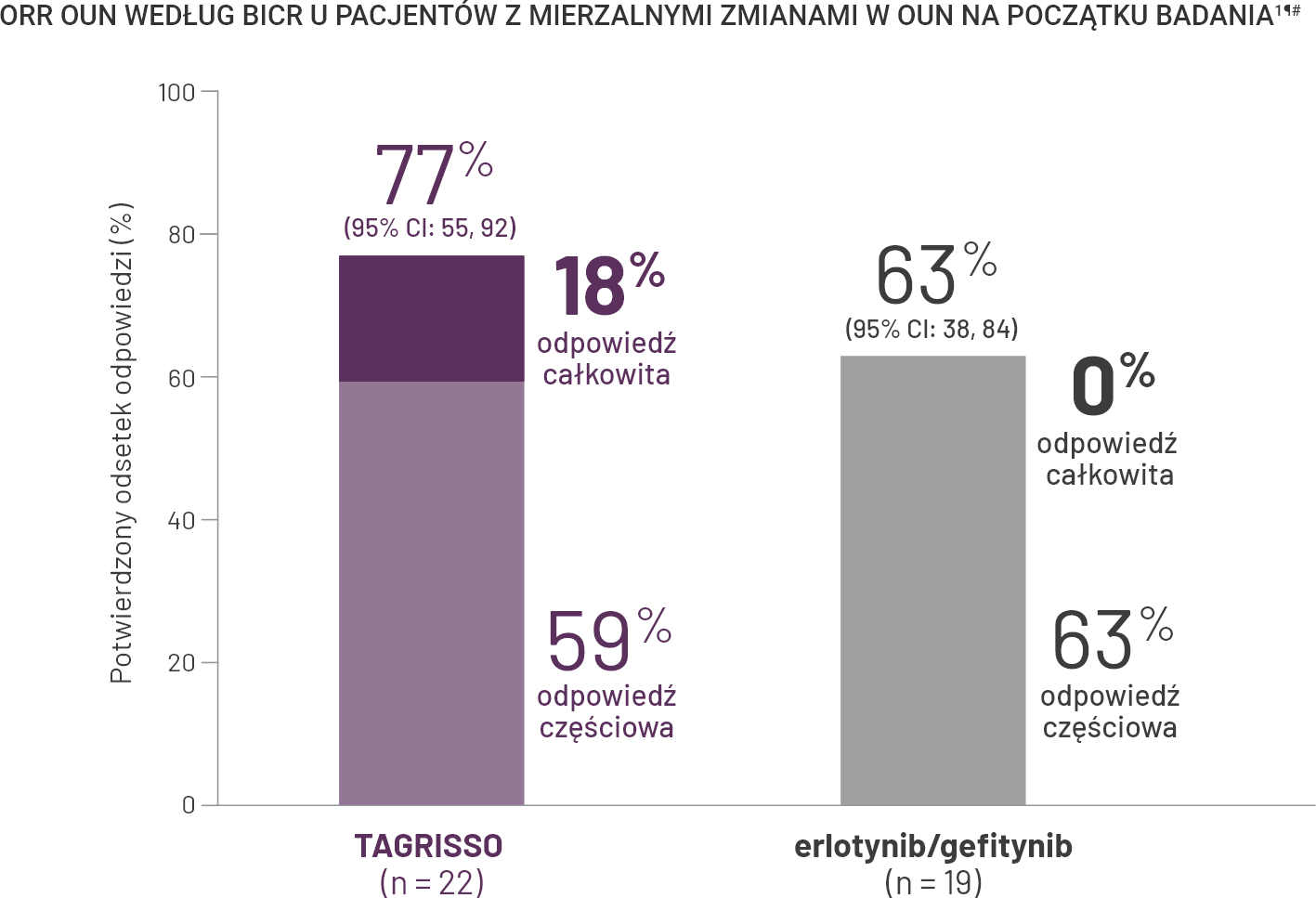
TAGRISSO w pierwszej linii leczenia: odsetek odpowiedzi obiektywnych w OUN i wskaźniki progresji choroby§.
Lek TAGRISSO przenikał przez barierę krew-mózg (BBB) w modelach przedklinicznych i przez nienaruszoną BBB w badaniu z udziałem dorosłych zdrowych ochotników1,10–12‡‡.
§19% (n = 10) pacjentów, u których rozpoznano lub leczono przerzuty do OUN w momencie włączenia do badania (całkowita liczba pacjentów ze znanymi lub leczonymi przerzutami do OUN, n = 53) miało progresję w OUN versus 43% (n = 27) chorych leczonych erlotynibem/gefitynibem ze znanymi lub leczonymi przerzutami do OUN w momencie włączenia do badania (całkowita liczba pacjentów ze znanymi lub leczonymi przerzutami do OUN, n = 63)9.
II3% (n = 7) pacjentów leczonych TAGRISSO bez stwierdzonych przerzutów do OUN w momencie włączenia do badania (całkowita liczba pacjentów bez znanych lub leczonych przerzutów do OUN, n = 226) miało progresję OUN w porównaniu z 7% (n = 15) pacjentów leczonych erlotynibem/gefitynibem (całkowita liczba pacjentów bez rozpoznanych lub leczonych przerzutów do OUN, n = 214)9.
¶Była to wstępnie zaplanowana analiza eksploracyjna.
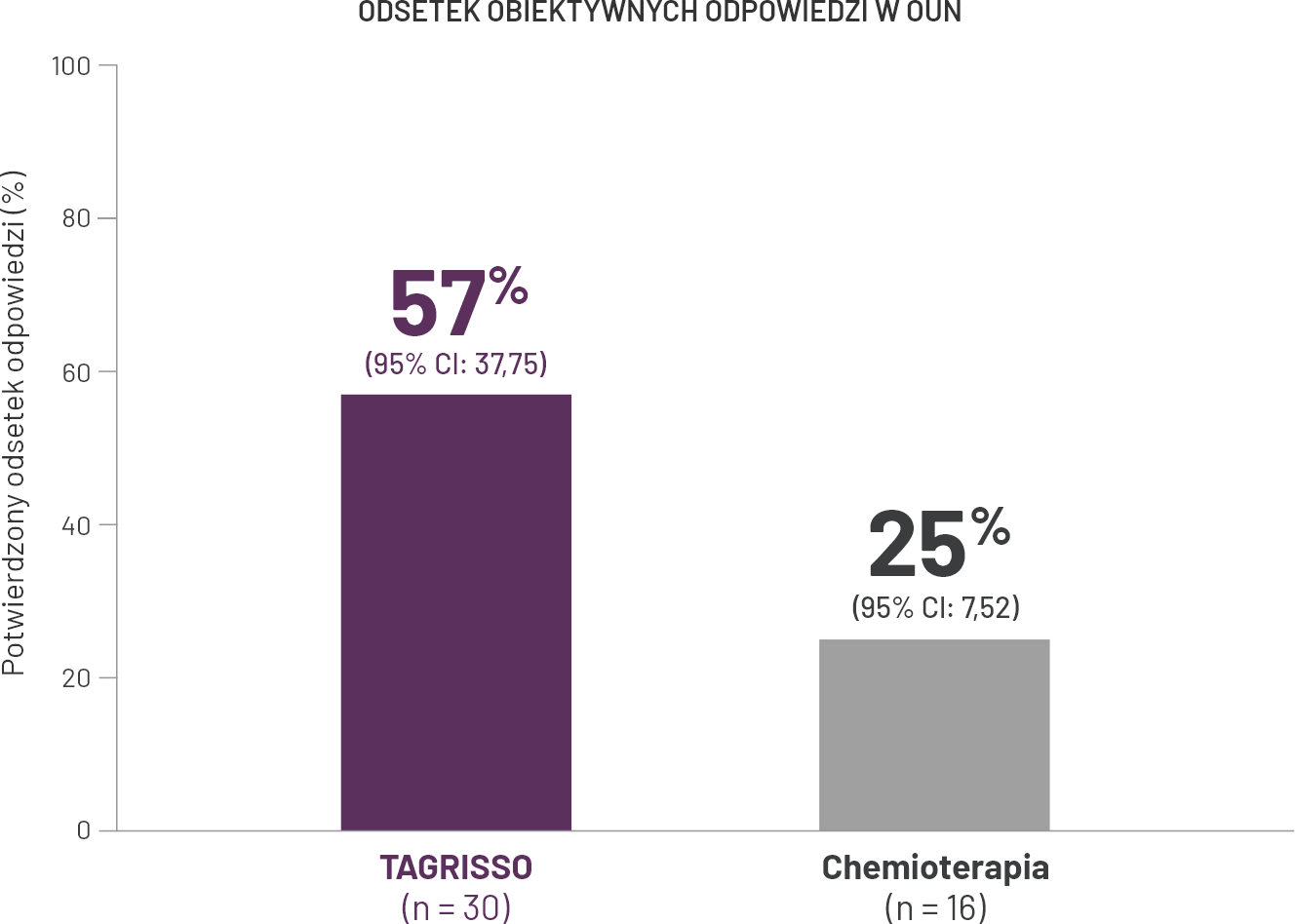
#Na podstawie potwierdzonej odpowiedzi.
**Na podstawie oceny badacza.
††Zdarzenia związane z progresją, które nie wystąpiły w ciągu 2 zaplanowanych wizyt od ostatniej oceny lub randomizacji, są cenzurowane i w związku z tym wykluczone z liczby zdarzeń (z wyłączeniem zgonów)9.
‡‡Opis badania: ośmiu (8) zdrowych ochotników płci męskiej (w wieku 52 ± 8 lat) poddano badaniu przez ~90 minut z obrazowaniem PET po podaniu pojedynczej dożylnej mikrodawki (1,3 μg; zakres 1,1–1,4 μg) leku TAGRISSO znakowanego izotopem węgla 11C. Stężenie leku TAGRISSO znakowanego izotopem węgla 11C mierzono również we krwi tętniczej i żylnej, jak również w osoczu. Obliczono parametry farmakokinetyczne Cmax (mózg), Tmax (mózg) oraz AUC0–90 min stosunek mózg/krew. Monitorowanie bezpieczeństwa i tolerancji obejmowało rejestrowanie zdarzeń niepożądanych, parametrów życiowych i EKG12.
Projekt badania FLAURA
FLAURA: badanie fazy III, podwójnie zaślepione, randomizowane, międzynarodowe1,4*.
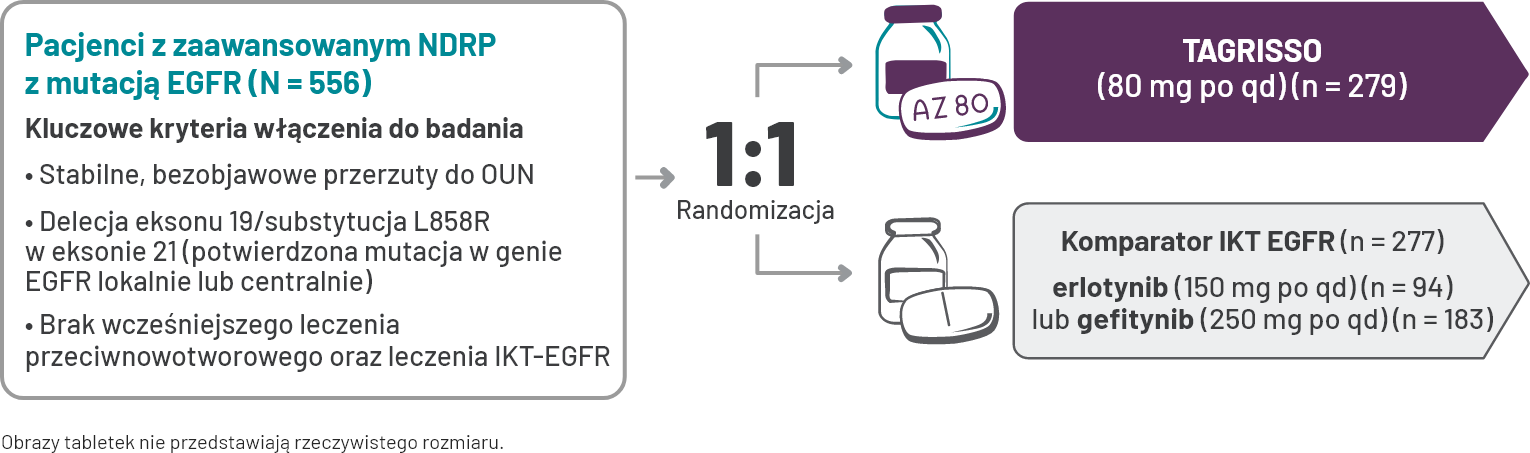
Pacjentom z grupy otrzymującej erlotynib/gefitynib po potwierdzonej progresji choroby ze stwierdzoną mutacją genu EGFR T790M pozwolono na rozpoczęcie terapii TAGRISSO w drugiej linii leczenia.

†Pacjenci otrzymywali erlotynib lub gefitynib jako jedyny komparator wybrany przez badacza5.
‡Ocena RECIST V 1.1 co 6 tygodni (± 1 tydzień) do czasu obiektywnej progresji choroby. Co 12 tygodni (± 1 tydzień) po 18 miesiącach5.
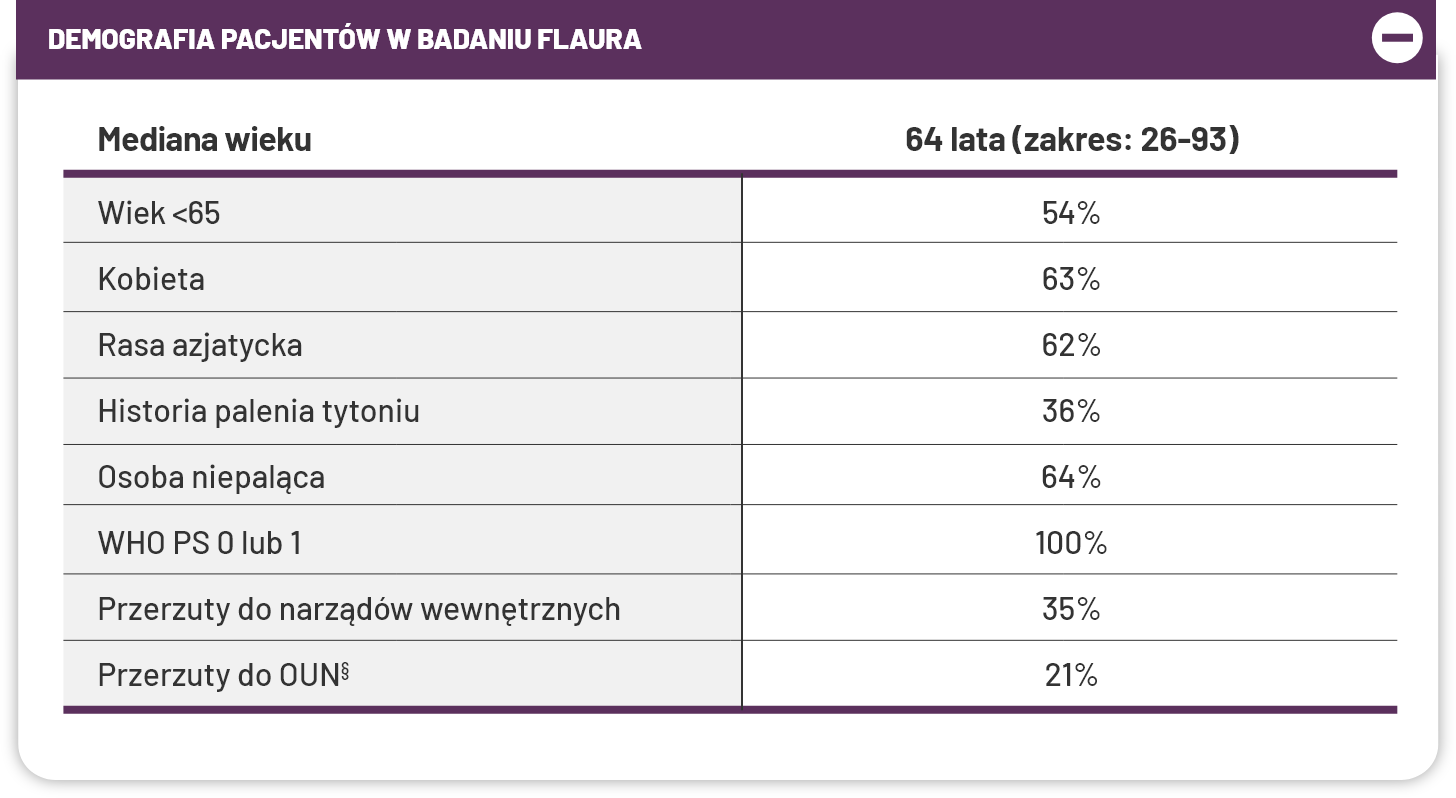
§Obejmuje przerzuty poza klatką piersiową1,4.
*Rozpoznane na podstawie miejsca zmiany OUN na początku badania, wywiadu lekarskiego i/lub wcześniejszego zabiegu chirurgicznego i/lub wcześniejszej radioterapii przerzutów do OUN1,4.
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
AES, zdarzenia niepożądane; AUC, pole pod krzywą; BICR, zaślepiona niezależna komisja centralna; CI, przedział ufności; OUN, ośrodkowy układ nerwowy; CR, odpowiedź całkowita; ctDNA, krążące DNA nowotworowe; DoR, czas trwania odpowiedzi; EKG, elektrokardiogram; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; HR, współczynnik ryzyka; L858R, substytucja leucyny 858 argininą w eksonie 21; MRI, obrazowanie metodą rezonansu magnetycznego; NC, niemożliwe do obliczenia; NCCN®, National Comprehensive Cancer Network®; NDRP, niedrobnokomórkowy rak płuca; OR, iloraz szans; ORR, odsetek odpowiedzi obiektywnych; OS, przeżycie całkowite; PET, pozytonowa tomografia emisyjna; PFS, czas przeżycia wolny od progresji choroby; PK, farmakokinetyka; po, doustnie; PR, odpowiedź częściowa; PS, stan sprawności; qd, raz na dobę; RECIST, Kryteria oceny odpowiedzi na leczenie w guzach litych; T790M, substytucja metioniny w eksonie 20 treoniną w pozycji 790; TKI, inhibitor kinazy tyrozynowej; WHO, Światowa Organizacja Zdrowia.
1. Charakterystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024].
2. Ramalingam SS, Vansteenkiste J, Planchard D, et al; FLAURA Investigators. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med. 2020;382(1):41-50.
3. Cytowane za zgodą NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.5.2022. ©National Comprehensive Cancer Network, Inc. 2022. Wszystkie prawa zastrzeżone. Dostęp 26 września 2022 r. Aby przejrzeć najnowszą i kompletną wersję wytycznych, odwiedź stronę NCCN.org. NCCN nie udziela żadnych gwarancji dotyczących treści, ich użytkowania lub zastosowania oraz zrzeka się wszelkiej odpowiedzialności za ich zastosowanie lub użytkowanie w dowolny sposób.
4. Soria JC, Ohe Y, Vansteenkiste J, et al; FLAURA Investigators. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018;378(2):113-125.
5. Soria JC, Ohe Y, Vansteenkiste J, et al; FLAURA Investigators. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018;378(2):113-125 [protocol].
6. Li L, Luo S, Lin H, et al. Correlation between EGFR mutation status and the incidence of brain metastases in patients with non-small cell lung cancer. J Thorac Dis. 2017;9(8):2510-2520.
7. Rangachari D, Yamaguchi N, VanderLaan PA, et al. Brain metastases in patients with EGFR-mutated or ALK-rearranged non-small-cell lung cancers. Lung Cancer. 2015;88(1):108-111.
8. Reungwetwattana T, Nakagawa K, Cho BC, et al. CNS response to osimertinib versus standard epidermal growth factor receptor tyrosine kinase inhibitors in patients with untreated EGFR-mutated advanced non-small-cell lung cancer. J Clin Oncol. 2018;36(33):3290–3297.
9. Soria JC, Ohe Y, Vansteenkiste J, et al; FLAURA Investigators. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018;378(2):113-125 [dodatek uzupełniający].
10. Ballard P, Yates JW, Yang Z, et al. Preclinical comparison of osimertinib with other EGFR-TKIs in EGFR-mutant NSCLC brain metastases models, and early evidence of clinical brain metastases activity. Clin Cancer Res. 2016;22(20):5130-5140.
11. Colclough N, Chen K, Johnström P, Fridén M, McGinnity DF. Building on the success of osimertinib: achieving CNS exposure in oncology drug discovery. Drug Discov Today. 2019;24(5):1067-1073.
12. Varrone A, Varnäs K, Jucaite A, et al. A PET study in healthy subjects of brain exposure of 11C-labeled osimertinib—a drug intended for treatment of brain metastases in non-small cell lung cancer. J Cereb Blood Flow Metab. 2020;40(4):799-807.
Profil bezpieczeństwa

Większość działań niepożądanych w badaniu FLAURA występowała w stopniu 1 lub 21.
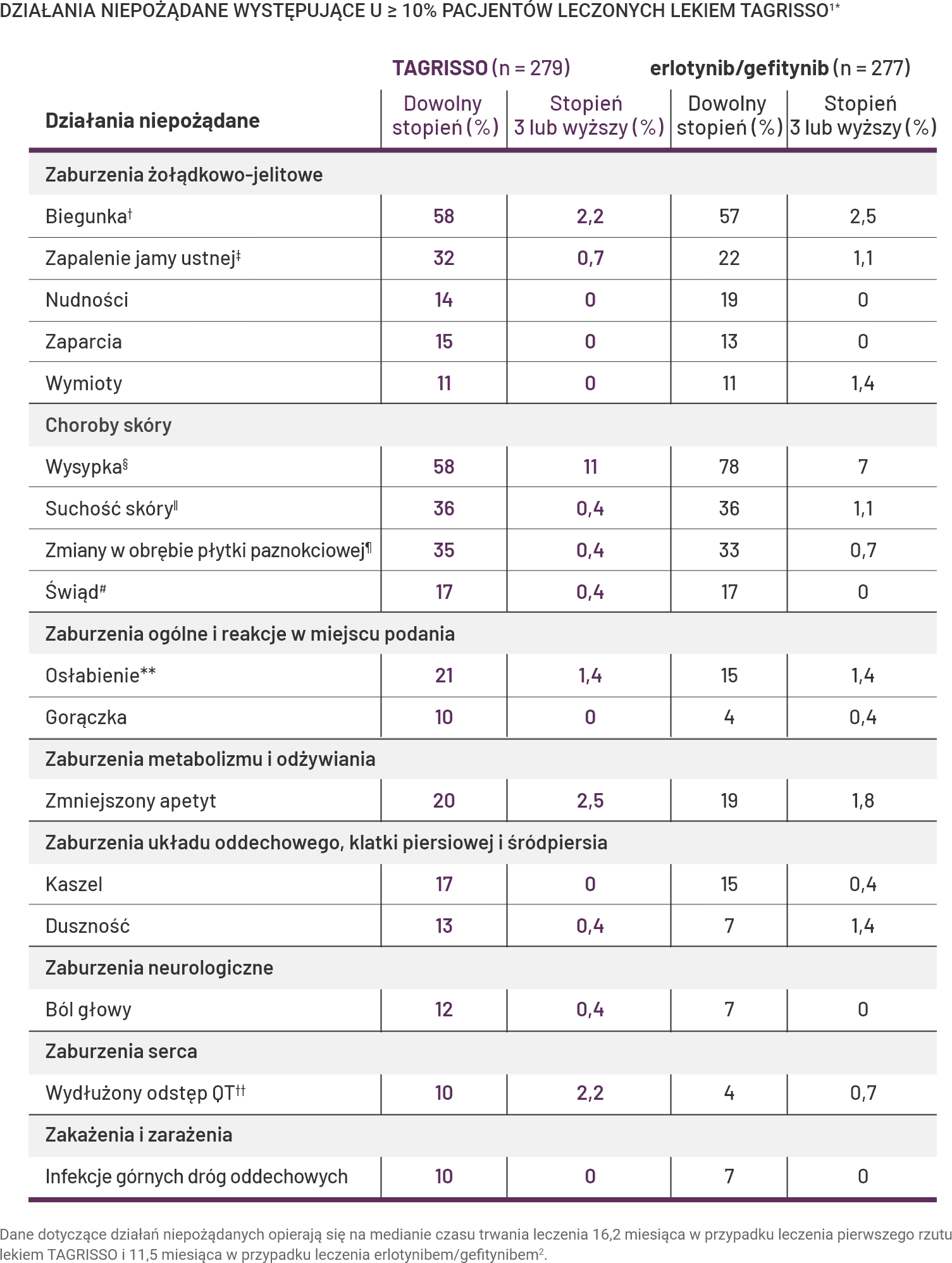
Klinicznie istotne działania niepożądane w badaniu FLAURA stwierdzono u <10% pacjentów przyjmujących lek TAGRISSO. Obejmowały one: łysienie (7%), krwawienie z nosa (6%), śródmiąższową chorobę płuc (3,9%), pokrzywkę (2,2%), zespół erytrodyzestezji dłoniowo-podeszwowej (1,4%), wydłużenie odstępu QTc (1,1%) i zapalenie rogówki (0,4%). Wydłużenie odstępu QTc oznacza częstość występowania wydłużenia odstępu QTcF >500 ms1.
Częstość przerywania leczenia i zmniejszenie dawki z powodu działań niepożądanych1
-
Ostateczne zaprzestanie podawania: 13% w przypadku TAGRISSO‡‡.
-
Zmniejszenie dawki: 2,9% pacjentów leczonych lekiem TAGRISSO§§.
*NCI CTCAE v4.0.
†Zgłoszono jedno zdarzenie stopnia 5 (zakończone zgonem) (biegunka) dla leku porównawczego EGFR-TKI.
‡W tym zapalenie jamy ustnej i owrzodzenie jamy ustnej.
§W tym wysypka ogólna, wysypka rumieniowa, wysypka plamista, wysypka plamisto-grudkowa, wysypka grudkowa, wysypka, swędząca, wysypka pęcherzykowa, rogowacenie okołomieszkowe, rumień, zapalenie mieszków włosowych, trądzik, zapalenie skóry, zmiany trądzikopodobne, wysypka polekowa, nadżerki, krosty.
||W tym suchość, stwardnienie skóry, kseroza, wyprysk, skóra pergaminowata.
¶W tym zmiany w obrębie łożyska paznokci, zapalenie łożyska paznokci, zakażenie łożyska paznokci, odbarwienie paznokci, pigmentacja paznokci, zmiany w obrębie płytki paznokciowej, dystrofia paznokci, zakażenie paznokci, bruzdy na paznokciach, ból w obrębie paznokci, łamliwość paznokci, onychomadeza, zmięknienie paznokci, zanokcica.
#W tym świąd, świąd uogólniony, świąd powiek.
**W tym zmęczenie, astenia.
††W tym wydłużony odstęp QT zgłaszany jako działanie niepożądane.
‡‡Najczęstszym działaniem niepożądanym prowadzącym do przerwania leczenia lekiem TAGRISSO było ILD/zapalenie płuc (3,9%).
§§Najczęstszymi działaniami niepożądanymi prowadzącymi do zmniejszenia dawki lub przerwania leczenia były wydłużenie odstępu QT zgodnie z oceną EKG (4,3%), biegunka (2,5%) i limfopenia (1,1%).
Zaburzenia wyników badań laboratoryjnych
TAGRISSO w pierwszej linii leczenia: większość odchyleń w wynikach badań laboratoryjnych w badaniu FLAURA była stopnia 1 lub 21.
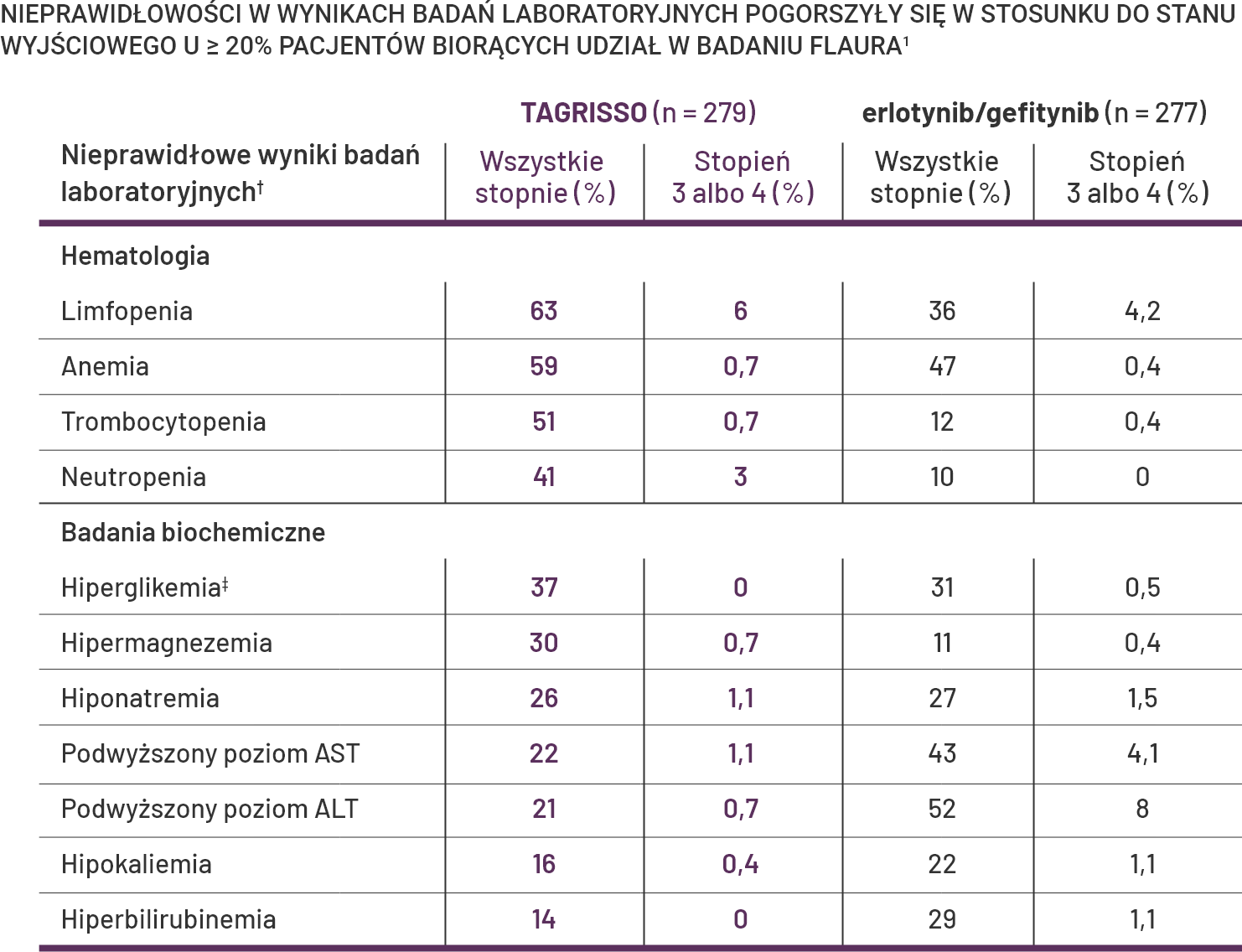
Klinicznie istotną nieprawidłowością w wynikach badań laboratoryjnych, która wystąpiła u <20% pacjentów otrzymujących lek TAGRISSO, było zwiększenie stężenia kreatyniny we krwi (9%)1.
Po 3 latach 28% pacjentów nadal było leczonych lekiem TAGRISSO w porównaniu z 9% w ramieniu erlotynib/gefitynib3 §.
*NCI CTCAE v4.0.
†Każda częstość występowania incydentu, z wyjątkiem hiperglikemii, jest oparta na liczbie pacjentów, dla których były dostępne zarówno pomiary wyjściowe, jak i co najmniej jeden pomiar laboratoryjny w trakcie badania (zakres TAGRISSO: 267–273 i zakres komparatora EGFR-TKI: 256–268)1.
†Hiperglikemia jest oparta na liczbie pacjentów, dla których były dostępne zarówno pomiary wyjściowe, jak i co najmniej jeden pomiar laboratoryjny w trakcie badania: TAGRISSO (179) i komparator EGFR-TKI (191)1.
§W badaniu FLAURA, zgodnie z oceną badacza, leczenie poza punktem progresji choroby było dozwolone tak długo, jak długo utrzymywała się korzyść kliniczna. Informacje dotyczące dawkowania i podawania produktu leczniczego TAGRISSO w leczeniu 1L zaawansowanego NDRP z mutacją EGFR znajdują się w Charakterystyce produktu leczniczego TAGRISSO2.
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
ALT, aminotransferaza alaninowa; ARs, działania niepożądane; AspAT, aminotransferaza asparaginianowa; CTCAE, wspólne kryteria terminologiczne dotyczące zdarzeń niepożądanych; EKG, elektrokardiogram; EGFR, receptor naskórkowego czynnika wzrostu; ILD, śródmiąższowa choroba płuc; NCI, Narodowy Instytut Onkologiczny; QTc, odstęp QT skorygowany o częstość akcji serca; QTcF, odstęp QT skorygowany metodą Fridericia; RTI, zakażenie dróg oddechowych; TKI, inhibitor kinazy tyrozynowej.
1. Charakterystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024].
2. Soria JC, Ohe Y, Vansteenkiste J, et al; FLAURA Investigators. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med. 2018;378(2):113-125.
3. Ramalingam SS, Vansteenkiste J, Planchard D, et al; FLAURA Investigators. Overall survival with osimertinib in untreated, EGFR-mutated advanced NSCLC. N Engl J Med. 2020;382(1):41-50.
AURA3

U pacjentów z NDRP z przerzutami z mutacją EGFR T790M, po leczeniu IKT EGFR pierwszej i drugiej generacji.
Lek TAGRISSO wykazał skuteczność w zakresie PFS w porównaniu z chemioterapią opartą o sole platyny.1*
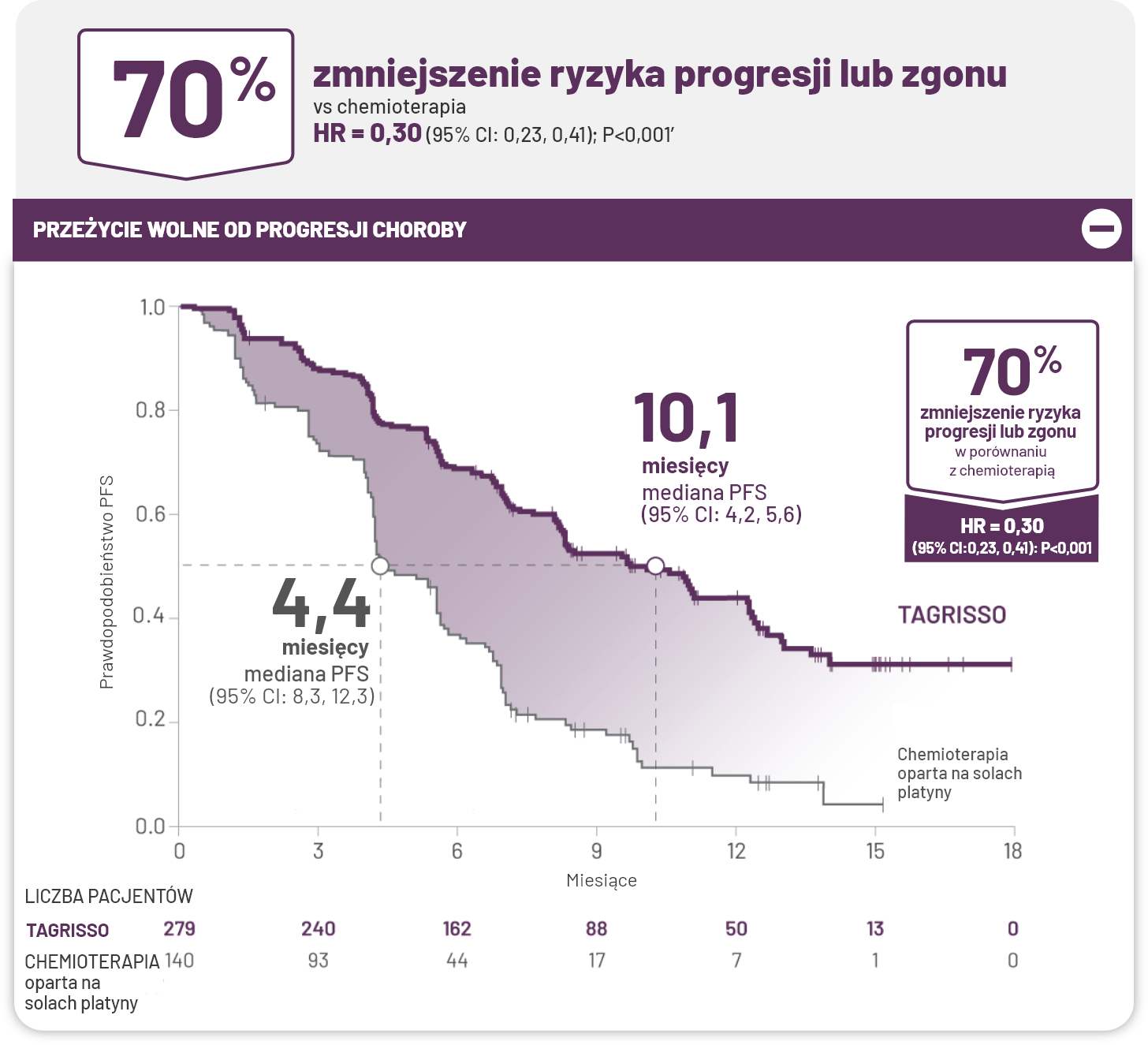
W badaniu klinicznym mediana PFS u pacjentów otrzymujących lek TAGRISSO
-
wynosiła 10,1 miesiąca (95% CI: 8,3, 12,3) w porównaniu z 4,4 miesiąca (95% CI: 4.2, 5.6) dla osób otrzymujących chemioterapię z zastosowaniem pochodnych platyny.
*Zgodnie z oceną badacza.
Aktywność leku TAGRISSO w OUN w badaniu AURA31
-
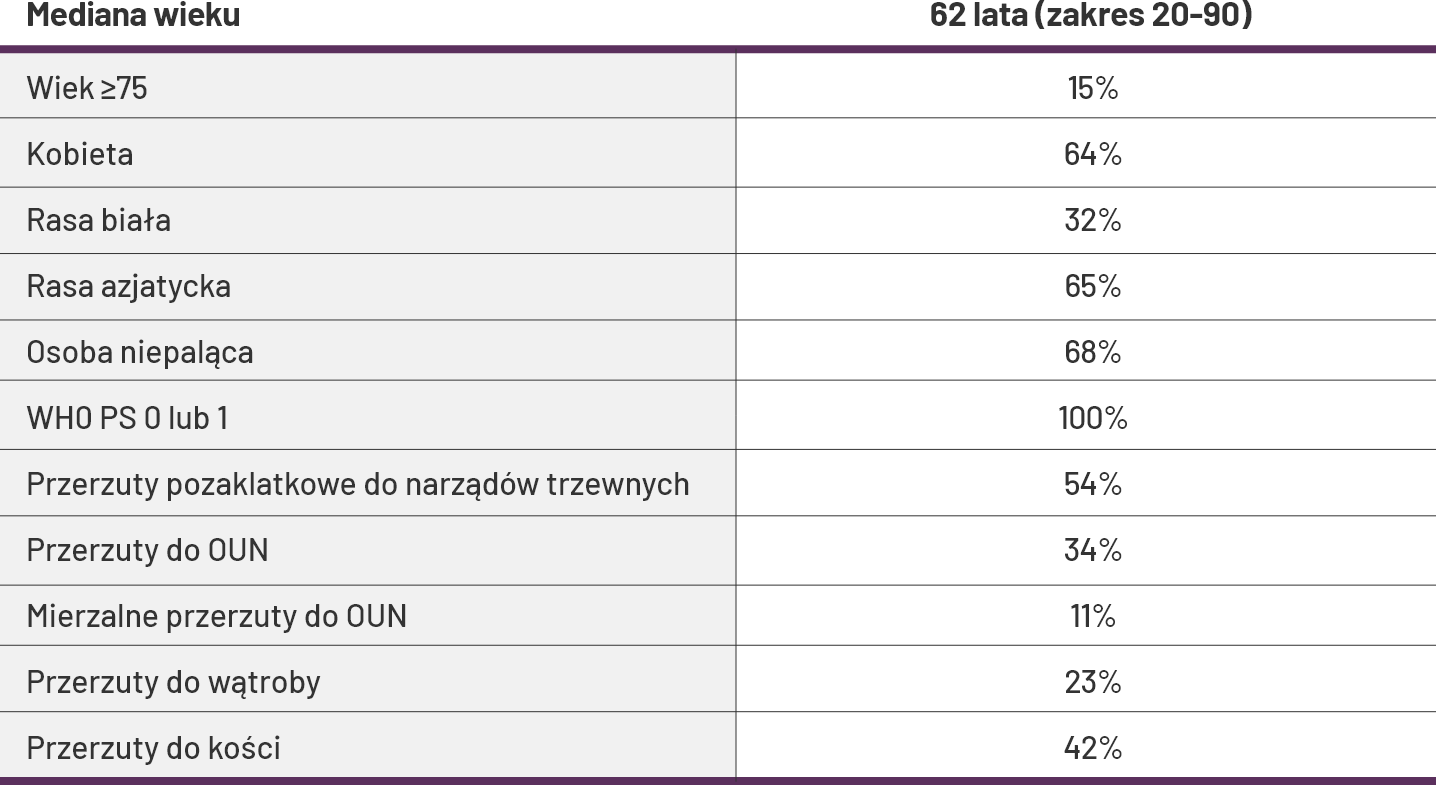
Na początku leczenia u 54% pacjentów stwierdzono pozaklatkowe przerzuty do narządów trzewnych, w tym 34% z nich miało przerzuty do OUN (u 11% były one mierzalne), 23% chorych zanotowano przerzuty do wątroby. U 42% pacjentów potwierdzono przerzuty do kości.
-
Ocenę BICR skuteczności w OUN według RECIST V 1.1 przeprowadzono w podgrupie 46/419 (11%) pacjentów, u których stwierdzono mierzalne zmiany w OUN na podstawie wyjściowego skanowania mózgu.
Profil bezpieczeństwa leku TAGRISSO w badaniu AURA31
Działania niepożądane (wszystkich stopni) występujące u ≥10% pacjentów leczonych lekiem TAGRISSO i chemioterapią opartą o sole platyny*.
-
Nie zgłoszono zdarzeń stopnia 4.
-
Nie zgłoszono żadnego pojedynczego ciężkiego działania niepożądanego (zdefiniowanego jako stopień 3 lub 4) u 2% lub więcej pacjentów przyjmujących lek TAGRISSO.
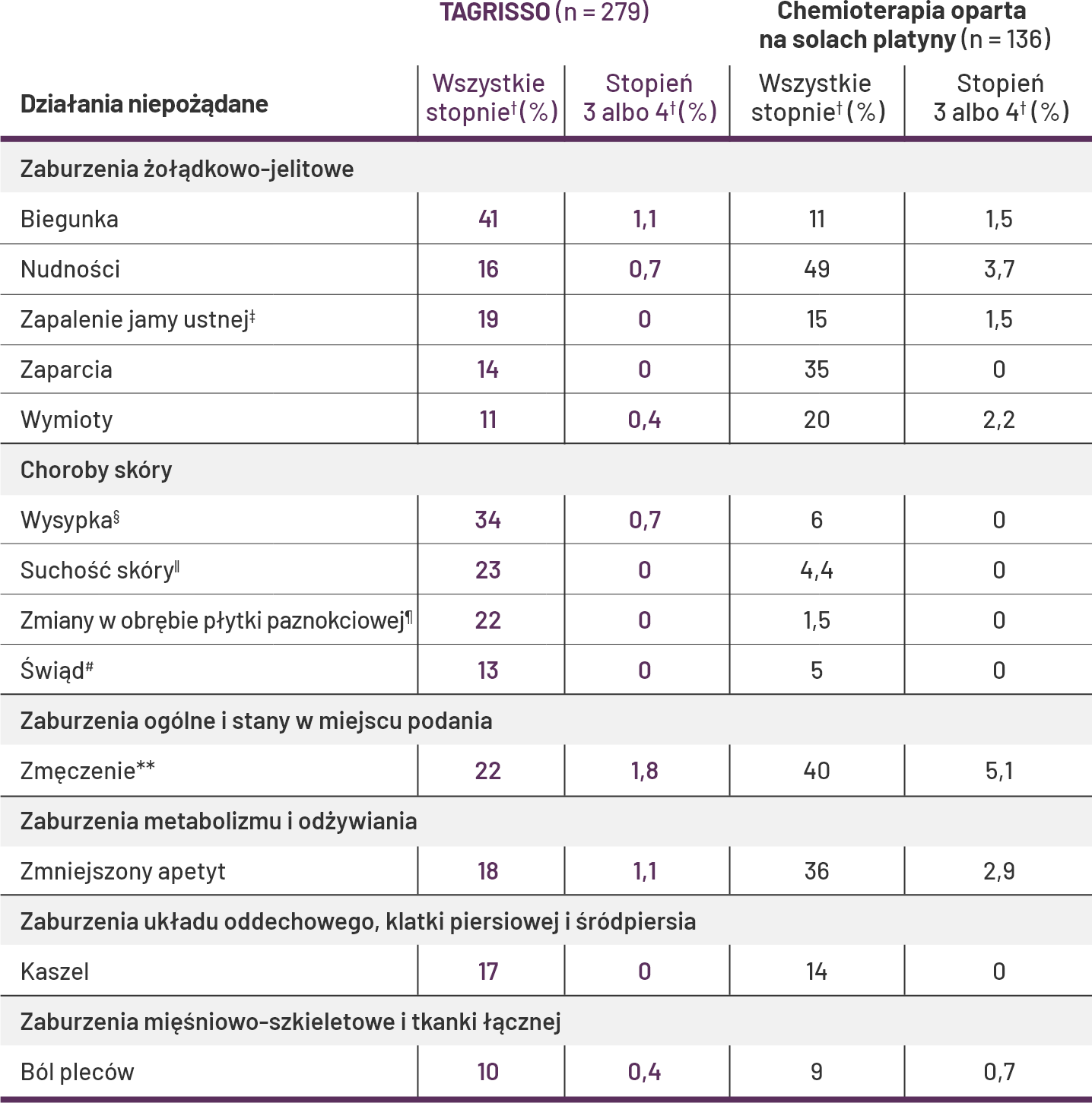
U 2,9% pacjentów przyjmujących lek TAGRISSO raz na dobę w badaniu AURA3 zmniejszono dawkę.
*NCI CTCAE v4.0.
†Nie zgłoszono zdarzeń stopnia 4.
‡W tym zapalenie jamy ustnej i owrzodzenie jamy ustnej.
§W tym wysypka, wysypka uogólniona, wysypka rumieniowa, wysypka plamista, wysypka plamisto-grudkowa, wysypka grudkowa, wysypka krostkowa, rumień, zapalenie mieszków włosowych, trądzik, zapalenie skóry, trądzikopodobne zmiany skórne, krosty.
||W tym sucha skóra, egzema, pękanie skóry, kseroza.
¶W tym zmiany w obrębie paznokci, zmiany w obrębie łożyska paznokci, stan zapalny łożyska paznokci, bolesność łożyska paznokci, odbarwienie paznokci, dystrofia paznokci, zakażenie paznokci, bruzdy na paznokciach, toksyczność paznokci, ból w obrębie paznokci, łamliwość paznokci, onycholiza, onychomadeza, zanokcica.
#W tym świąd, świąd uogólniony, świąd powiek.
**W tym zmęczenie, astenia.
Klinicznie istotne działania niepożądane w badaniu AURA3 u <10% pacjentów otrzymujących lek TAGRISSO obejmowały krwawienie z nosa (5%), śródmiąższową chorobę płuc (3,9%), łysienie (3,6%), pokrzywkę (2,9%), zespół erytrodyzestezji dłoniowo-podeszwowej (1,8%), wydłużenie odstępu QTc (1,4%), zapalenie rogówki (1,1%) i rumień wielopostaciowy (0,7%). Wydłużenie odstępu QTc oznacza częstość występowania wydłużenia odstępu QTcF > 500 ms.
Większość nieprawidłowości w wynikach badań laboratoryjnych była stopnia 1. lub 21.
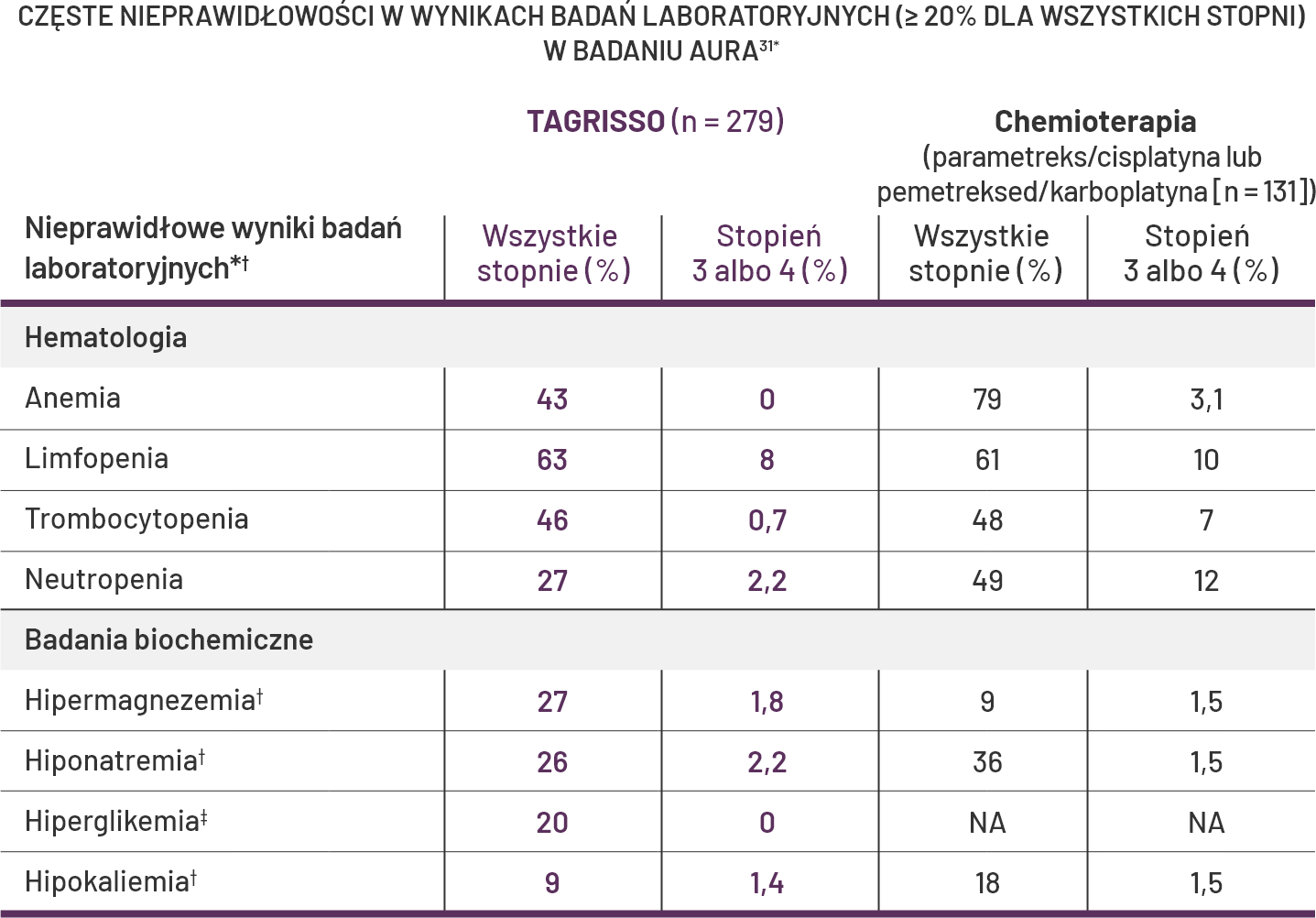
*NCI CTCAE v4.0.
†Każda częstość występowania incydentu, z wyjątkiem hiperglikemii, jest oparta na liczbie pacjentów, dla których były dostępne zarówno pomiary wyjściowe, jak i co najmniej jeden pomiar laboratoryjny w trakcie badania (TAGRISSO 279, komparator chemioterapii 131).
‡Hiperglikemia jest oparta na liczbie pacjentów, dla których były dostępne zarówno pomiary wyjściowe, jak i co najmniej jeden pomiar laboratoryjny w trakcie badania (TAGRISSO 270, chemioterapia 5; glukoza na czczo nie była wymogiem protokołu dla pacjentów z grupy chemioterapii).
Klinicznie istotne nieprawidłowości w wynikach badań laboratoryjnych u pacjentów biorących udział w badaniu AURA3, które wystąpiły u <20% pacjentów otrzymujących lek TAGRISSO, obejmowały zwiększenie stężenia kreatyniny we krwi (7%).
Projekt badania1,2
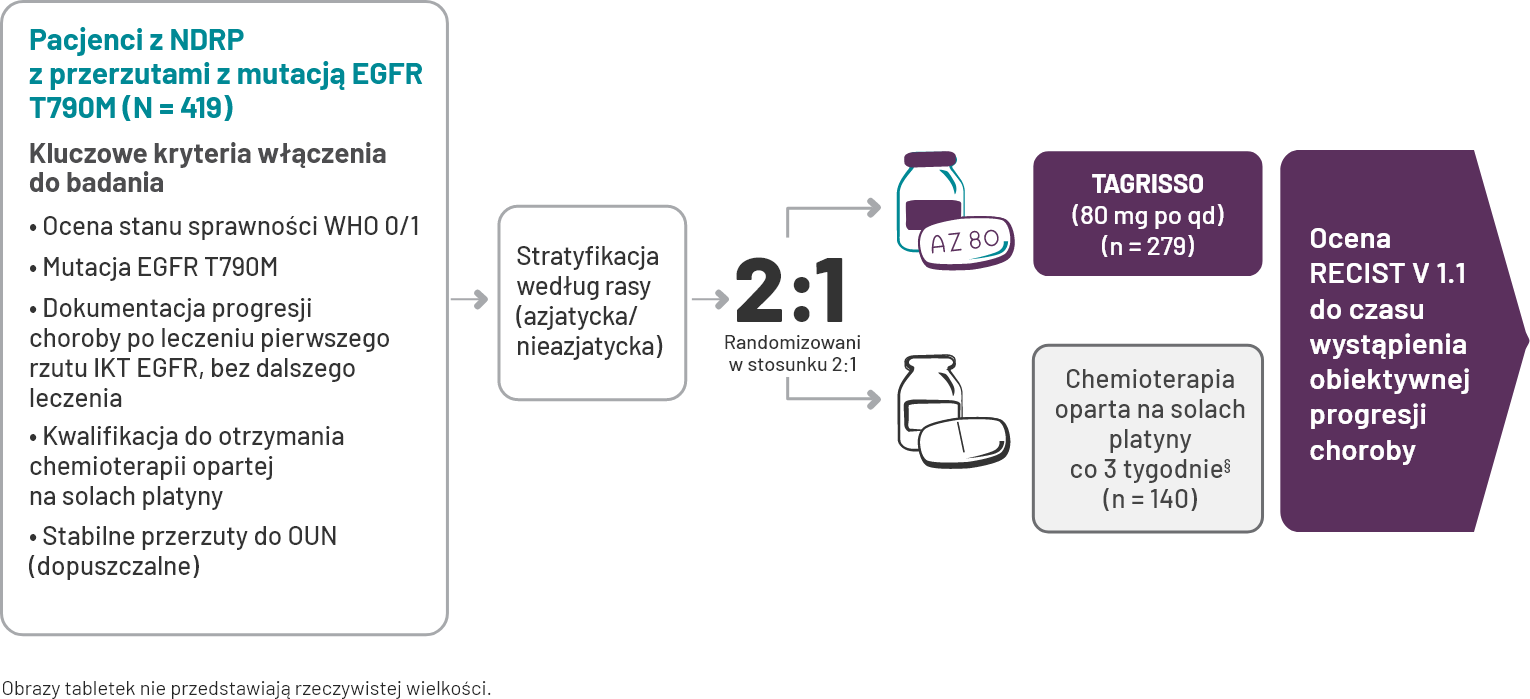
-
W grupie chemioterapii zezwolono na zmianę leczenia u pacjentów, którzy mogli otrzymywać lek TAGRISSO po potwierdzeniu progresji przez badacza i centralę.
Pierwszorzędowy punkt końcowy: przeżycie wolne od progresji choroby. Drugorzędowe punkty końcowe: całkowity odsetek odpowiedzi, czas trwania odpowiedzi i całkowity czas przeżycia.
§Pemetrexed 500 mg/m2 z karboplatyną (AUC5) lub pemetreksedem 500 mg/m2 z cisplatyną 75 mg/m2 przez okres do 6 cykli.
Podstawowe dane demograficzne1
W przypadku progresji choroby po zastosowaniu IKT EGFR pierwszej lub drugiej generacji należy przeprowadzić badanie na obecność mutacji oporności EGFR T790M.
Istnieje kilka walidowanych klinicznie testów wykrywających mutację EGFR T790M, które wykorzystują tkankę lub osocze1,3,4.
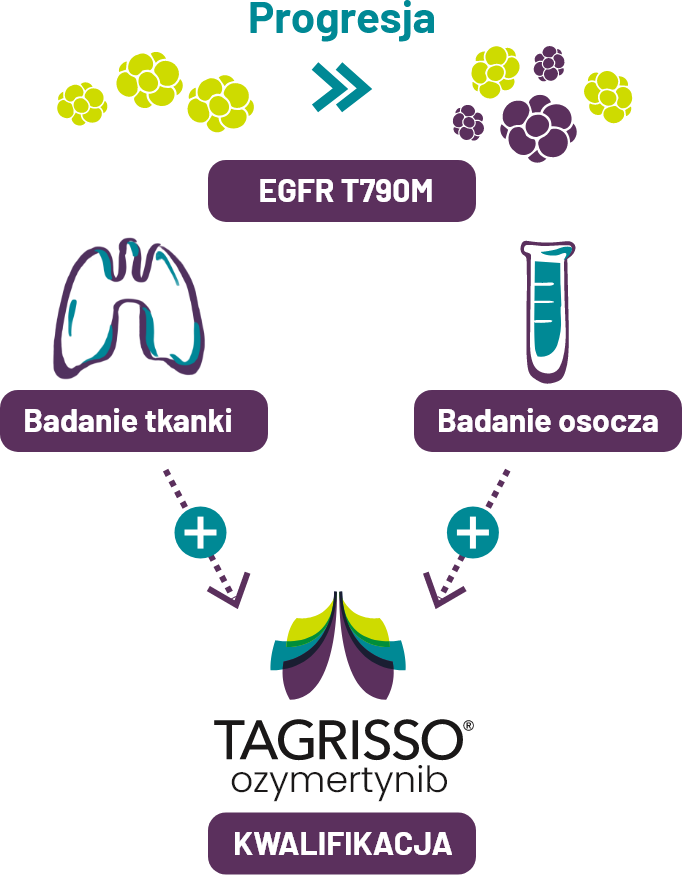
Ponowna ocena możliwości wykonania badania z tkanki w przypadku negatywnych wyników badania osocza1,3,4.
-
Wybór pacjentów do leczenia uogólnionego NDRP z mutacją EGFR T790M lekiem TAGRISSO w przypadku progresji w trakcie lub po zakończeniu leczenia IKT EGFR - na podstawie obecności mutacji EGFR T790M w próbkach guza lub osocza.
-
Badanie na obecność mutacji T790M w próbkach osocza zaleca się wyłącznie u pacjentów, u których nie można wykonać biopsji guza.
-
Jeżeli mutacja ta nie zostanie wykryta w próbce osocza, należy ponownie ocenić możliwość wykonania biopsji w celu zbadania tkanki guza.
WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
AUC, pole pod krzywą; BICR, niezależna komisja centralna; CI, przedział ufności; OUN, ośrodkowy układ nerwowy; CTCAE, wspólne kryteria terminologiczne dotyczące zdarzeń niepożądanych; EGFR, receptor naskórkowego czynnika wzrostu; FDA, Amerykańska Agencja ds. Żywności i Leków; HR, współczynnik ryzyka; NA, Nie dotyczy; NCI, Narodowy Instytut Onkologiczny; NDRP, niedrobnokomórkowy rak płuc; ORR, ogólny wskaźnik odpowiedzi; PFS, czas przeżycia wolny od progresji choroby; po, doustnie; PS, stan sprawności; qd, raz na dobę; QTc, odstęp QT skorygowany względem częstości akcji serca; QTcF, odstęp QT skorygowany według metody Fridericia; RECIST, Kryteria oceny odpowiedzi na leczenie w guzach litych; T790M, substytucja treoniny metioniną w eksonie 20 w pozycji 790; TKI, inhibitor kinazy tyrozynowej; WHO, Światowa Organizacja Zdrowia.
1. Charakterystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024].
2. Mok TS, Wu YL, Ahn MJ, et al; AURA3 Investigators. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med. 2017;376(7):629-640.
3. cobas® EGFR Mutation Test v2 [ulotka informacyjna]. Indianapolis, IN: Roche Molecular Systems, Inc.; 2021.
4. Guardant 360 Cdx [ulotka informacyjna]. Redwood City, CA: Guardant Health, Inc.; 2021.
Dawkowanie


WSKAZANIA
Produkt leczniczy TAGRISSO w monoterapii jest wskazany w:
-
leczeniu uzupełniającym po radykalnej resekcji guza u dorosłych pacjentów z niedrobnokomórkowym rakiem płuca (NDRP) w stadium zaawansowania IB-IIIA z potwierdzoną mutacją delecji w egzonie 19 lub substytucji w egzonie 21 (L858R) w genie kodującym receptor naskórkowego czynnika wzrostu (ang. EGFR),
-
leczeniu pierwszego rzutu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP, z mutacjami aktywującymi w genie kodującym EGFR,
-
leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub uogólnionym NDRP z obecną mutacją T790M w genie kodującym EGFR.
Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca, klikając tutaj.
1L, leczenie pierwszej linii; 2L, leczenie drugiej linii; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; L858R, substytucja leucyny 858 argininą w eksonie 21; mNDRP, niedrobnokomórkowy rak płuca z przerzutami; NG, nosowo-żołądkowy; NDRP, niedrobnokomórkowy rak płuc; T790M, substytucja treoniny w metioninę w pozycji 790 w eksonie 20.
1. Charakterystyka Produktu Leczniczego Tagrisso [dostęp: 02.2024].
Ocena mutacji w genie kodującym EGFR
Jeżeli rozważane jest zastosowanie produktu leczniczego TAGRISSO w leczeniu uzupełniającym po radykalnej resekcji guza u pacjentów z NDRP, potwierdzenie mutacji (delecja w egzonie 19 – Ex19del lub substytucji w egzonie 21 L858R) jest warunkiem koniecznym do inicjacji terapii ozymertynibem. Ocena obecności mutacji powinna zostać przeprowadzona w laboratoriach klinicznych z wykorzystaniem zwalidowanych testów na podstawie DNA z materiału histologicznego pozyskanego podczas biopsji lub z materiału pooperacyjnego. Jeżeli rozważane jest zastosowanie produktu leczniczego TAGRISSO w leczeniu miejscowo zaawansowanego lub uogólnionego NDRP, ważne jest, aby potwierdzona została obecność mutacji w genie kodującym EGFR. Oznaczenie należy wykonać przy użyciu walidowanej metody testowej z użyciem DNA pozyskanego z tkanki guza lub wolnego krążącego DNA nowotworowego (ctDNA) pozyskanego z osocza. Dodatni wynik oznaczenia statusu mutacji w genie kodującym EGFR (mutacje aktywujące w genie EGFR w przypadku leczenia pierwszego rzutu, mutacje delecji w eksonie 19 lub substytucji w eksonie 21 (L858R), gdy produkt leczniczy TAGRISSO jest podawany w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny w leczeniu pierwszego rzutu lub mutacje oporności T790M w przypadku progresji w trakcie lub po zakończonej terapii inhibitorami kinaz tyrozynowych) testem przeznaczonym do badania materiału z tkanki guza lub z próbki osocza wskazuje na to, że pacjent kwalifikuje się do leczenia produktem leczniczym TAGRISSO. Jednakże, w przypadku oznaczania mutacji na podstawie badania ctDNA z próbki osocza i uzyskania wyniku ujemnego zalecane jest, o ile tylko jest to możliwe, wykonanie testu z wykorzystaniem tkanki guza, ze względu na możliwość uzyskiwania wyników fałszywie ujemnych w badaniu z próbki osocza. Do oceny należy wykorzystać wyłącznie stabilne, wiarygodne i czułe testy o udowodnionej użyteczności w diagnostyce mutacji w genie kodującym EGFR. Śródmiąższowa choroba płuc (ang. ILD) U pacjentów leczonych produktem leczniczym TAGRISSO w ramach badań klinicznych obserwowano występowanie ciężkiej, zagrażającej życiu lub prowadzącej do zgonu śródmiąższowej choroby płuc (ang. Interstitial Lung Disease, ILD) lub reakcje podobne do ILD (np. zapalenie płuc). W większości przypadków poprawa lub całkowite ustąpienie tego stanu następowało po przerwaniu stosowania leku. Pacjenci, u których uprzednio występowała śródmiąższowa choroba płuc, lub lekopochodna ILD, lub popromienne zapalenie płuc wymagające leczenia steroidami oraz pacjenci z jakimikolwiek objawami klinicznie czynnej ILD byli wykluczani z udziału w badaniach klinicznych (patrz punkt 4.8 w ChPL). W badaniach klinicznych ADAURA, FLAURA, FLAURA2 i AURA występowanie śródmiąższowej choroby płuc (ILD) lub reakcji podobnych do ILD zgłaszano u 4,0% spośród 1813 pacjentów, którzy otrzymywali produkt leczniczy TAGRISSO w monoterapii. Odnotowano 7 zgonów w przypadku leczenia pacjentów z miejscowo zawansowanym i uogólnionym NDRP. Nie odnotowano żadnego zgonu w przypadku leczenia uzupełniającego ozymertynibem. Częstość występowania ILD wynosiła 11,2% wśród Japończyków, 2,3% wśród Azjatów niebędących Japończykami oraz 2,7% wśród pacjentów pochodzenia nieazjatyckiego (patrz punkt 4.8 w ChPL). W badaniu klinicznym FLAURA2 występowanie ILD lub reakcji podobnych do ILD zgłoszono u 3,3%, a przypadki śmiertelne u 0,4% (n=1) spośród 276 pacjentów, którzy otrzymywali produkt leczniczy TAGRISSO w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny. Częstość występowania ILD wynosiła 14,9% wśród Japończyków oraz 1,7% wśród pacjentów pochodzenia nieazjatyckiego; u żadnego spośród pacjentów pochodzenia azjatyckiego niebędących Japończykami nie wystąpiło zdarzenie ILD w grupie otrzymującej leczenie skojarzone w badaniu FLAURA2. Mediana czasu od podania pierwszej dawki do początku ILD lub reakcji podobnych do ILD wyniosła 161 dni. U wszystkich pacjentów, u których dojdzie do wystąpienia ostrych objawów i (lub) niewyjaśnionego nasilenia objawów ze strony układu oddechowego (np. duszności, kaszlu, gorączki), należy natychmiast wykonać badania w celu wykluczenia ILD. W trakcie tej diagnostyki należy wstrzymać stosowanie tego produktu leczniczego. W przypadku potwierdzenia rozpoznania śródmiąższowej choroby płuc należy zaprzestać stosowania produktu leczniczego TAGRISSO i wdrożyć odpowiednie postępowanie u pacjenta. Wznowienie podawania produktu leczniczego TAGRISSO należy rozważyć wyłącznie po dokładnym uwzględnieniu korzyści i ryzyka u danego pacjenta. Ciężkie skórne działania niepożądane (ang. severe cutaneous adverse reactions, SCARs) W związku z leczeniem produktem leczniczym TAGRISSO raportowano przypadki zespołu Stevensa-Johnsona (SJS) i toksycznej nekrolizy naskórka (TEN) z częstością występowania mieszczącą się odpowiednio w kategorii „rzadko” i „częstość nieznana”. Przed rozpoczęciem leczenia należy pouczyć pacjentów o przedmiotowych i podmiotowych objawach SJS i TEN. W razie wystąpienia objawów przedmiotowych i podmiotowych sugerujących SJS lub TEN, leczenie produktem TAGRISSO należy przerwać. W przypadku rozpoznania SJS lub TEN leczenie produktem TAGRISSO należy natychmiast zakończyć. Wydłużenie odstępu QTc U pacjentów leczonych produktem leczniczym TAGRISSO może wystąpić wydłużenie odstępu QTc. Wydłużenie odstępu QTc może prowadzić do zwiększenia ryzyka wystąpienia tachyarytmii komorowych (np. torsade de pointes) lub nagłego zgonu. W badaniach ADAURA, FLAURA, FLAURA2 i AURA nie zgłaszano występowania u pacjentów jakichkolwiek arytmii związanych z wydłużeniem odstępu QTc (patrz punkt 4.8 w ChPL). Pacjenci z klinicznie istotnymi zaburzeniami rytmu i przewodzenia stwierdzonymi na podstawie spoczynkowych zapisów elektrokardiograficznych (EKG) (np. z odstępem QTc powyżej 470 msec) byli wykluczeni z udziału w tych badaniach (patrz punkt 4.8 w ChPL). O ile to możliwe, należy unikać stosowania produktu leczniczego TAGRISSO u pacjentów z wrodzonym zespołem wydłużonego odstępu QT. Należy rozważyć okresowe monitorowanie z wykonywaniem zapisów elektrokardiograficznych (EKG) oraz oznaczeń stężeń elektrolitów u pacjentów z zastoinową niewydolnością serca, zaburzeniami gospodarki elektrolitowej, a także u tych pacjentów, którzy przyjmują produkty lecznicze, o których wiadomo, że wydłużają odstęp QTc. Należy wstrzymać stosowanie u pacjentów, u których dojdzie do wydłużenia odstępu QTc powyżej 500 ms w co najmniej 2 odrębnych badaniach EKG do czasu powrotu odstępu QTc do wartości mniejszej niż 481 ms lub do powrotu odstępu QTc do wartości wyjściowej, jeżeli odstęp QTc wynosi 481 ms lub więcej, a następnie należy wznowić stosowanie produktu leczniczego TAGRISSO w zmniejszonej dawce zgodnie z instrukcjami podanymi w Tabeli 1. Należy trwale zaprzestać stosowania produktu leczniczego TAGRISSO u pacjentów, u których nastąpi wydłużenie odstępu QTc w połączeniu z którymkolwiek spośród następujących zaburzeń: torsade de pointes, polimorficzny częstoskurcz komorowy, objawy ciężkich zaburzeń rytmu serca. Zmiany kurczliwości serca W badaniach klinicznych, u pacjentów leczonych lekiem TAGRISSO w monoterapii, u których wykonano pomiar frakcji wyrzutowej lewej komory serca (ang. LVEF) w warunkach wyjściowych oraz co najmniej jeden pomiar kontrolny, zmniejszenie LVEF o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50% występowały u 4,2% pacjentów (65/1557). U pacjentów z kardiologicznymi czynnikami ryzyka oraz z zaburzeniami, które mogą wpływać na LVEF, należy rozważyć prowadzenie monitorowania czynności serca, w tym pomiary LVEF w warunkach wyjściowych oraz w trakcie leczenia. U pacjentów, u których wystąpią istotne objawy przedmiotowe lub podmiotowe ze strony serca podczas leczenia, należy rozważyć prowadzenie monitorowania czynności serca, w tym pomiary LVEF. W przypadku kontrolowanego placebo badania ADAURA z zastosowaniem produktu leczniczego TAGRISSO w leczeniu uzupełniającym 1,5% (5/325) w grupie pacjentów otrzymujących ozymertynib oraz 1,5% (5/331) z grupy kontrolnej doświadczyło LVEF zmniejszenie frakcji wyrzutowej lewej komory (LVEF) o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50%. W badaniu FLAURA2 u 8,0% (21/262) pacjentów leczonych produktem TAGRISSO w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny, u których wykonano pomiar LVEF w warunkach wyjściowych oraz co najmniej jeden pomiar kontrolny wystąpiło zmniejszenie LVEF o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50%. Zapalenie rogówki zgłaszano u 0,6% (n=10) spośród 1813 pacjentów leczonych lekiem TAGRISSO w monoterapii w ramach badań ADAURA, FLAURA, FLAURA2 i AURA. Pacjenci z objawami przedmiotowymi i podmiotowymi wskazującymi na zapalenie rogówki, takimi jak ostre lub nasilające się: zapalenie oka, łzawienie, nadwrażliwość na światło, niewyraźne widzenie, ból oka i (lub) zaczerwienienie oka, powinni zostać niezwłocznie skierowani do lekarza okulisty (patrz punkt 4.2 Tabela 1 w ChPL). Niedokrwistość aplastyczna W związku z leczeniem produktem leczniczym TAGRISSO zgłaszano rzadkie przypadki niedokrwistości aplastycznej, w tym zdarzenia śmiertelne. Przed rozpoczęciem leczenia należy pacjentów pouczyć w zakresie przedmiotowych i podmiotowych objawów niedokrwistości aplastycznej, w tym między innymi utrzymującej się gorączki, powstawania wylewów podskórnych, krwawienia, bladości, zakażenia i uczucia zmęczenia. Jeśli wystąpią przedmiotowe i podmiotowe objawy sugerujące niedokrwistość aplastyczną, należy rozważyć ścisłe monitorowanie pacjenta i przerwanie lub zakończenie podawania produktu leczniczego TAGRISSO. Leczenie produktem TAGRISSO należy zakończyć u pacjentów z potwierdzoną niedokrwistością aplastyczną (patrz punkt 4.2 w ChPL). Wiek i masa ciała Pacjenci w podeszłym wieku (> 65 lat) lub pacjenci o niskiej masie ciała (<50 kg) mogą być narażeni na zwiększone ryzyko wystąpienia działań niepożądanych stopnia 3. lub wyższego. Zaleca się ścisłe monitorowanie tych pacjentów (patrz punkt 4.8 w ChPL). Sód Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) w tabletce, więc zasadniczo jest on „wolny od sodu”