Mechanizm działania

Mechanizm działania
TAGRISSO®
Zaawansowane i wczesne stadia NDRP z mutacją w genie EGFR
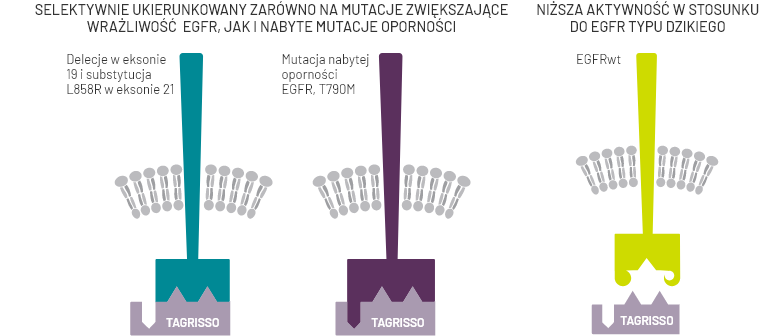
Tagrisso® jest inhibitorem kinazy tyrozynowej (ang. Tyrosine Kinase Inhibitor, TKI). Lek ten jest nieodwracalnym inhibitorem receptorów dla naskórkowego czynnika wzrostu (ang. Epidermal Growth Factor Receptors, EGFRs) z obecną mutacją w genie kodującym te receptory prowadzącą do zwiększenia wrażliwości (EGFRm) lub mutacją T790M warunkującą oporność na TKI.

*Opis badania: Ośmiu (8) zdrowych ochotników płci męskiej (w wieku 52 ± 8 lat) poddano badaniu przez ~ 90 minut z obrazowaniem PET po podaniu pojedynczej dożylnej mikrodozy (1,3 μg; zakres 1,1-1,4 μg) leku TAGRISSO® znakowanego izotopem węgla 11C. Stężenie leku TAGRISSO® znakowanego izotopem węgla 11C mierzono również we krwi tętniczej i żylnej oraz w osoczu. Wykonano MRI mózgu, który wykorzystano do współrejestrowania danych PET i automatycznego wyznaczania interesujących obszarów w mózgu. Obliczono parametry farmakokinetyczne Cmax (mózg), Tmax (mózg) oraz stosunek mózg/krew AUC0-90 min. Monitorowanie bezpieczeństwa i tolerancji obejmowało rejestrowanie zdarzeń niepożądanych, parametrów życiowych i EKG4.
WSKAZANIA

Należy zapoznać się w całości z Charakterystyką Produktu Leczniczego TAGRISSO®, w tym z ulotką dla pacjenta.
Może Pan/Pani zgłosić działania niepożądane związane z produktami firmy AstraZeneca klikając tutaj.
1LL,pierwsza linia leczenia2LL, druga linia leczenia ; CI, przedział ufności; DFS, przeżycie wolne od choroby; EGFR, receptor naskórkowego czynnika wzrostu; EGFRm, mutacja receptora naskórkowego czynnika wzrostu; HR, współczynnik ryzyka; L858R, substytucja w eksonie 21; mNSCLC, niedrobnokomórkowy rak płuca z przerzutami; NE, niemożliwe do oszacowania; NDRP, niedrobnokomórkowy rak płuc; ORR, odsetek odpowiedzi obiektywnych ; OS, przeżycie całkowite; PFS, czas przeżycia wolny od progresji choroby; T790M, mutacja , w eksonie 20; TKI, inhibitor kinazy tyrozynowej.
- Charakterystyka Produktu Leczniczego Tagrisso® [dostęp: 02.2024]
- AstraZeneca Media Centre. Komunikat prasowy AURA. https://www.astrazeneca.com/media-centre/press-releases/2015/TAGRISSO-AZD9291-approved-by-the-US-FDA-for-patients-with-EGFR-T790M-mutation-positive-metastatic-non-small-cell-lung-cancer-13112015.html. Opublikowano 13 listopada 2015 r. Dostęp 10 września 2020 r.
- Cytowane za zgodą NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.5.2022. ©National Comprehensive Cancer Network, Inc. 2022. Wszystkie prawa zastrzeżone. Dostęp 26 września 2022 r. Aby przejrzeć najnowszą i kompletną wersję wytycznych, odwiedź stronę NCCN.org. NCCN nie udziela żadnych gwarancji dotyczących treści, ich użytkowania lub zastosowania oraz zrzeka się wszelkiej odpowiedzialności za ich zastosowanie lub użytkowanie w dowolny sposób.
- AstraZeneca Media Centre. Komunikat prasowy AURA3. https://www.astrazeneca.com/media-centre/press-releases/2017/tagrisso-osimertinib-receives-us-fda-full-approval-31032017.html. Opublikowano 31 marca 2017 r. Dostęp 10 września 2020 r.
PL-16693
Ocena mutacji w genie kodującym EGFR
Jeżeli rozważane jest zastosowanie produktu leczniczego TAGRISSO w leczeniu uzupełniającym po radykalnej resekcji guza u pacjentów z NDRP, potwierdzenie mutacji (delecja w egzonie 19 – Ex19del lub substytucji w egzonie 21 L858R) jest warunkiem koniecznym do inicjacji terapii ozymertynibem. Ocena obecności mutacji powinna zostać przeprowadzona w laboratoriach klinicznych z wykorzystaniem zwalidowanych testów na podstawie DNA z materiału histologicznego pozyskanego podczas biopsji lub z materiału pooperacyjnego. Jeżeli rozważane jest zastosowanie produktu leczniczego TAGRISSO w leczeniu miejscowo zaawansowanego lub uogólnionego NDRP, ważne jest, aby potwierdzona została obecność mutacji w genie kodującym EGFR. Oznaczenie należy wykonać przy użyciu walidowanej metody testowej z użyciem DNA pozyskanego z tkanki guza lub wolnego krążącego DNA nowotworowego (ctDNA) pozyskanego z osocza. Dodatni wynik oznaczenia statusu mutacji w genie kodującym EGFR (mutacje aktywujące w genie EGFR w przypadku leczenia pierwszego rzutu, mutacje delecji w eksonie 19 lub substytucji w eksonie 21 (L858R), gdy produkt leczniczy TAGRISSO jest podawany w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny w leczeniu pierwszego rzutu lub mutacje oporności T790M w przypadku progresji w trakcie lub po zakończonej terapii inhibitorami kinaz tyrozynowych) testem przeznaczonym do badania materiału z tkanki guza lub z próbki osocza wskazuje na to, że pacjent kwalifikuje się do leczenia produktem leczniczym TAGRISSO. Jednakże, w przypadku oznaczania mutacji na podstawie badania ctDNA z próbki osocza i uzyskania wyniku ujemnego zalecane jest, o ile tylko jest to możliwe, wykonanie testu z wykorzystaniem tkanki guza, ze względu na możliwość uzyskiwania wyników fałszywie ujemnych w badaniu z próbki osocza. Do oceny należy wykorzystać wyłącznie stabilne, wiarygodne i czułe testy o udowodnionej użyteczności w diagnostyce mutacji w genie kodującym EGFR. Śródmiąższowa choroba płuc (ang. ILD) U pacjentów leczonych produktem leczniczym TAGRISSO w ramach badań klinicznych obserwowano występowanie ciężkiej, zagrażającej życiu lub prowadzącej do zgonu śródmiąższowej choroby płuc (ang. Interstitial Lung Disease, ILD) lub reakcje podobne do ILD (np. zapalenie płuc). W większości przypadków poprawa lub całkowite ustąpienie tego stanu następowało po przerwaniu stosowania leku. Pacjenci, u których uprzednio występowała śródmiąższowa choroba płuc, lub lekopochodna ILD, lub popromienne zapalenie płuc wymagające leczenia steroidami oraz pacjenci z jakimikolwiek objawami klinicznie czynnej ILD byli wykluczani z udziału w badaniach klinicznych (patrz punkt 4.8 w ChPL). W badaniach klinicznych ADAURA, FLAURA, FLAURA2 i AURA występowanie śródmiąższowej choroby płuc (ILD) lub reakcji podobnych do ILD zgłaszano u 4,0% spośród 1813 pacjentów, którzy otrzymywali produkt leczniczy TAGRISSO w monoterapii. Odnotowano 7 zgonów w przypadku leczenia pacjentów z miejscowo zawansowanym i uogólnionym NDRP. Nie odnotowano żadnego zgonu w przypadku leczenia uzupełniającego ozymertynibem. Częstość występowania ILD wynosiła 11,2% wśród Japończyków, 2,3% wśród Azjatów niebędących Japończykami oraz 2,7% wśród pacjentów pochodzenia nieazjatyckiego (patrz punkt 4.8 w ChPL). W badaniu klinicznym FLAURA2 występowanie ILD lub reakcji podobnych do ILD zgłoszono u 3,3%, a przypadki śmiertelne u 0,4% (n=1) spośród 276 pacjentów, którzy otrzymywali produkt leczniczy TAGRISSO w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny. Częstość występowania ILD wynosiła 14,9% wśród Japończyków oraz 1,7% wśród pacjentów pochodzenia nieazjatyckiego; u żadnego spośród pacjentów pochodzenia azjatyckiego niebędących Japończykami nie wystąpiło zdarzenie ILD w grupie otrzymującej leczenie skojarzone w badaniu FLAURA2. Mediana czasu od podania pierwszej dawki do początku ILD lub reakcji podobnych do ILD wyniosła 161 dni. U wszystkich pacjentów, u których dojdzie do wystąpienia ostrych objawów i (lub) niewyjaśnionego nasilenia objawów ze strony układu oddechowego (np. duszności, kaszlu, gorączki), należy natychmiast wykonać badania w celu wykluczenia ILD. W trakcie tej diagnostyki należy wstrzymać stosowanie tego produktu leczniczego. W przypadku potwierdzenia rozpoznania śródmiąższowej choroby płuc należy zaprzestać stosowania produktu leczniczego TAGRISSO i wdrożyć odpowiednie postępowanie u pacjenta. Wznowienie podawania produktu leczniczego TAGRISSO należy rozważyć wyłącznie po dokładnym uwzględnieniu korzyści i ryzyka u danego pacjenta. Ciężkie skórne działania niepożądane (ang. severe cutaneous adverse reactions, SCARs) W związku z leczeniem produktem leczniczym TAGRISSO raportowano przypadki zespołu Stevensa-Johnsona (SJS) i toksycznej nekrolizy naskórka (TEN) z częstością występowania mieszczącą się odpowiednio w kategorii „rzadko” i „częstość nieznana”. Przed rozpoczęciem leczenia należy pouczyć pacjentów o przedmiotowych i podmiotowych objawach SJS i TEN. W razie wystąpienia objawów przedmiotowych i podmiotowych sugerujących SJS lub TEN, leczenie produktem TAGRISSO należy przerwać. W przypadku rozpoznania SJS lub TEN leczenie produktem TAGRISSO należy natychmiast zakończyć. Wydłużenie odstępu QTc U pacjentów leczonych produktem leczniczym TAGRISSO może wystąpić wydłużenie odstępu QTc. Wydłużenie odstępu QTc może prowadzić do zwiększenia ryzyka wystąpienia tachyarytmii komorowych (np. torsade de pointes) lub nagłego zgonu. W badaniach ADAURA, FLAURA, FLAURA2 i AURA nie zgłaszano występowania u pacjentów jakichkolwiek arytmii związanych z wydłużeniem odstępu QTc (patrz punkt 4.8 w ChPL). Pacjenci z klinicznie istotnymi zaburzeniami rytmu i przewodzenia stwierdzonymi na podstawie spoczynkowych zapisów elektrokardiograficznych (EKG) (np. z odstępem QTc powyżej 470 msec) byli wykluczeni z udziału w tych badaniach (patrz punkt 4.8 w ChPL). O ile to możliwe, należy unikać stosowania produktu leczniczego TAGRISSO u pacjentów z wrodzonym zespołem wydłużonego odstępu QT. Należy rozważyć okresowe monitorowanie z wykonywaniem zapisów elektrokardiograficznych (EKG) oraz oznaczeń stężeń elektrolitów u pacjentów z zastoinową niewydolnością serca, zaburzeniami gospodarki elektrolitowej, a także u tych pacjentów, którzy przyjmują produkty lecznicze, o których wiadomo, że wydłużają odstęp QTc. Należy wstrzymać stosowanie u pacjentów, u których dojdzie do wydłużenia odstępu QTc powyżej 500 ms w co najmniej 2 odrębnych badaniach EKG do czasu powrotu odstępu QTc do wartości mniejszej niż 481 ms lub do powrotu odstępu QTc do wartości wyjściowej, jeżeli odstęp QTc wynosi 481 ms lub więcej, a następnie należy wznowić stosowanie produktu leczniczego TAGRISSO w zmniejszonej dawce zgodnie z instrukcjami podanymi w Tabeli 1. Należy trwale zaprzestać stosowania produktu leczniczego TAGRISSO u pacjentów, u których nastąpi wydłużenie odstępu QTc w połączeniu z którymkolwiek spośród następujących zaburzeń: torsade de pointes, polimorficzny częstoskurcz komorowy, objawy ciężkich zaburzeń rytmu serca. Zmiany kurczliwości serca W badaniach klinicznych, u pacjentów leczonych lekiem TAGRISSO w monoterapii, u których wykonano pomiar frakcji wyrzutowej lewej komory serca (ang. LVEF) w warunkach wyjściowych oraz co najmniej jeden pomiar kontrolny, zmniejszenie LVEF o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50% występowały u 4,2% pacjentów (65/1557). U pacjentów z kardiologicznymi czynnikami ryzyka oraz z zaburzeniami, które mogą wpływać na LVEF, należy rozważyć prowadzenie monitorowania czynności serca, w tym pomiary LVEF w warunkach wyjściowych oraz w trakcie leczenia. U pacjentów, u których wystąpią istotne objawy przedmiotowe lub podmiotowe ze strony serca podczas leczenia, należy rozważyć prowadzenie monitorowania czynności serca, w tym pomiary LVEF. W przypadku kontrolowanego placebo badania ADAURA z zastosowaniem produktu leczniczego TAGRISSO w leczeniu uzupełniającym 1,5% (5/325) w grupie pacjentów otrzymujących ozymertynib oraz 1,5% (5/331) z grupy kontrolnej doświadczyło LVEF zmniejszenie frakcji wyrzutowej lewej komory (LVEF) o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50%. W badaniu FLAURA2 u 8,0% (21/262) pacjentów leczonych produktem TAGRISSO w skojarzeniu z pemetreksedem i chemioterapią opartą na pochodnych platyny, u których wykonano pomiar LVEF w warunkach wyjściowych oraz co najmniej jeden pomiar kontrolny wystąpiło zmniejszenie LVEF o 10 punktów procentowych lub większe oraz zmniejszenie do mniej niż 50%. Zapalenie rogówki zgłaszano u 0,6% (n=10) spośród 1813 pacjentów leczonych lekiem TAGRISSO w monoterapii w ramach badań ADAURA, FLAURA, FLAURA2 i AURA. Pacjenci z objawami przedmiotowymi i podmiotowymi wskazującymi na zapalenie rogówki, takimi jak ostre lub nasilające się: zapalenie oka, łzawienie, nadwrażliwość na światło, niewyraźne widzenie, ból oka i (lub) zaczerwienienie oka, powinni zostać niezwłocznie skierowani do lekarza okulisty (patrz punkt 4.2 Tabela 1 w ChPL). Niedokrwistość aplastyczna W związku z leczeniem produktem leczniczym TAGRISSO zgłaszano rzadkie przypadki niedokrwistości aplastycznej, w tym zdarzenia śmiertelne. Przed rozpoczęciem leczenia należy pacjentów pouczyć w zakresie przedmiotowych i podmiotowych objawów niedokrwistości aplastycznej, w tym między innymi utrzymującej się gorączki, powstawania wylewów podskórnych, krwawienia, bladości, zakażenia i uczucia zmęczenia. Jeśli wystąpią przedmiotowe i podmiotowe objawy sugerujące niedokrwistość aplastyczną, należy rozważyć ścisłe monitorowanie pacjenta i przerwanie lub zakończenie podawania produktu leczniczego TAGRISSO. Leczenie produktem TAGRISSO należy zakończyć u pacjentów z potwierdzoną niedokrwistością aplastyczną (patrz punkt 4.2 w ChPL). Wiek i masa ciała Pacjenci w podeszłym wieku (> 65 lat) lub pacjenci o niskiej masie ciała (<50 kg) mogą być narażeni na zwiększone ryzyko wystąpienia działań niepożądanych stopnia 3. lub wyższego. Zaleca się ścisłe monitorowanie tych pacjentów (patrz punkt 4.8 w ChPL). Sód Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) w tabletce, więc zasadniczo jest on „wolny od sodu”

