PODWOJENIE mPFS W 2L JEST MOŻLIWE1

Pierwsza i jedyna terapia skojarzona powodująca ponad dwukrotne zwiększenie mPFS w porównaniu z samym fulwestrantem w badaniu III fazy, w którym większość pacjentów była leczona wcześniej iCDK4/6+ET2 HR+/HER2− zaawansowany rak piersi z jedną lub większą ilością zmian w genach PIK3CA/AKT1/PTEN po progresji na [ET ± CDK4/6i]1
Informacje o Produkcie Leczniczym Truqap®

Produkt leczniczy TRUQAP jest wskazany do stosowania w skojarzeniu z fulwestrantem w leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub przerzutowym rakiem piersi wykazującym ekspresję receptorów estrogenowych (ER-dodatnim), HER2-ujemnym z co najmniej jedną zmianą w genach PIK3CA/AKT1/PTEN, po nawrocie lub progresji, do których doszło w trakcie lub po terapii hormonalnej.
Badanie kliniczne CAPItello-2911
Pierwszorzędowym punktem końcowym badania CAPItello-291 było przeżycie wolne od progresji choroby (PFS) w populacji pacjentów z co najmniej jedną zmianą w genach PIK3CA/AKT1/PTEN1:
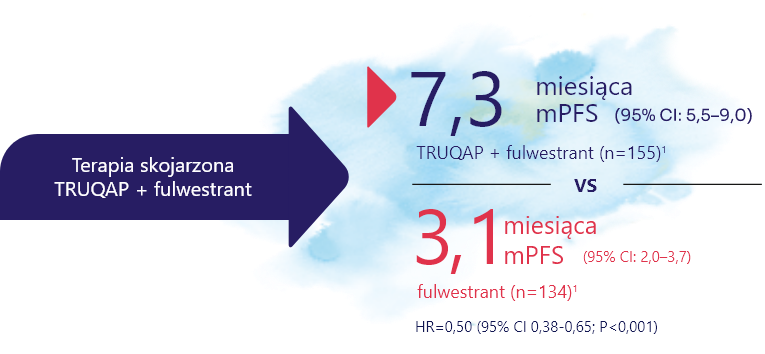
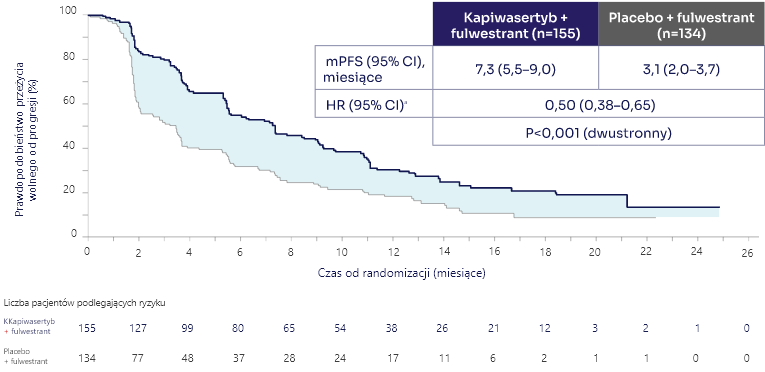
CAPItello-291 to randomizowane, wieloośrodkowe, podwójnie zaślepione badanie kliniczne III fazy, oceniające skuteczność i bezpieczeństwo stosowania kapiwasertybu (Truqap) w skojarzeniu z fulwestrantem u pacjentów z zaawansowanym rakiem piersi z obecnością zmian w genach PIK3CA, AKT1 lub PTEN. Badanie objęło pacjentów z ekspresją receptorów hormonalnych (HR+), HER2 ujemnych, którzy wcześniej mogli otrzymać do dwóch linii hormonoterapii i jedną linię chemioterapii w chorobie zaawansowanej.1
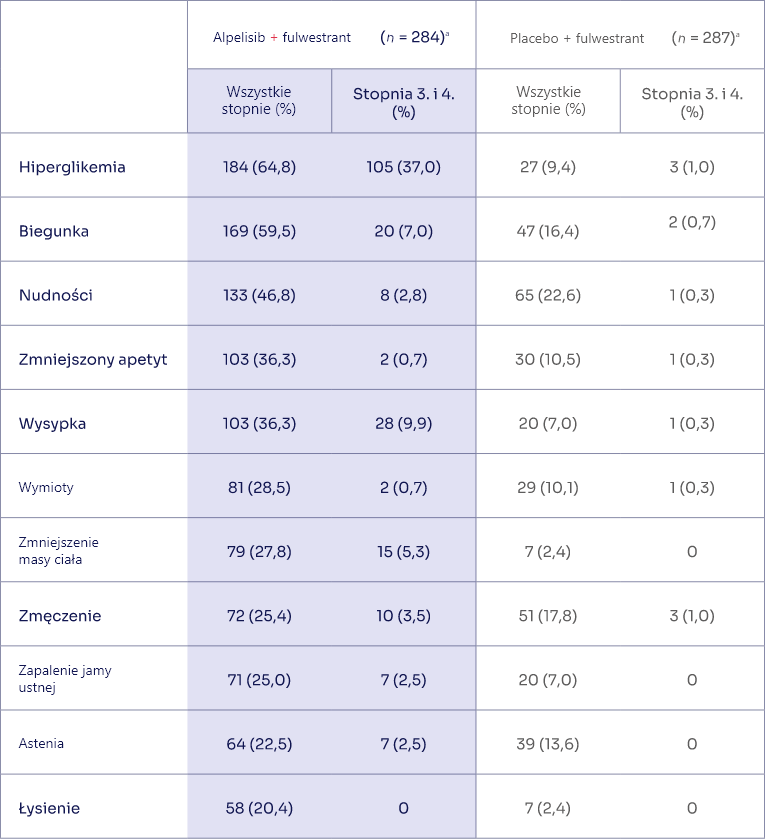
Profil bezpieczeństwa
w badaniu CAPItello-291 dla kapiwasertybu*,1


Profil bezpieczeństwa w badaniu SOLAR-1
dla alpelisybu*,3
Zmiany szlaku PIK3CA/AKT1/PTEN w raku piersi1

Diagnostyka szlaku AKT według polskich
i światowych wytycznych4-6

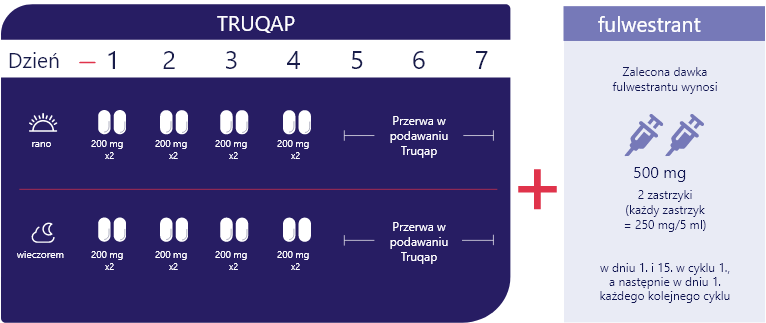
TRUQAP tygodniowy schemat dawkowania2
4 dni podawania leku, a następnie 3 dni przerwy

- Referencje:
- *Przedstawione wyniki pochodzą z dwóch odrębnych badań klinicznych (SOLAR-1 i CAPItello-291). Nie były to badania porównawcze typu head-to-head.
- 1. Turner NC i wsp. N Engl J Med. 2023;388(22):2058-2070.
- 2. Charakterystyka Produktu Leczniczego Truqap, 06/2024.
- 3. André F. I wsp. Alpelisib plus fulvestrant for PIK3CA-mutated, hormone receptor-positive, human epidermal growth factor receptor-2-negative advanced breast cancer: final overall survival results from SOLAR-1, 2021
- 4. Breast Cancer NCCN Guidelines Version 4.2024, November 20, 2024
- 5. Tysarowski A i wsp., Diagnostyka molekularna nowotworów — podejście praktyczne, 2023 (aktualizacja opracowania: październik 2024); 8(3): 212-226
- 6. https://www.streck.com/products/stabilization/cell-free-dna-bct-ivd/ (dostęp: 21.01.2025)
PL-24508
