Leczenie HER2 zależnego zaawansowanego raka piersi*

*Obwieszczenie Ministra Zdrowia z dnia 17 września 2025 r. w sprawie wykazu refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych na 1 października 2025 r.

Lek objęty refundacją
w leczeniu przerzutowego lub
miejscowo zaawansowanego
raka piersi HER2-low
w leczeniu przerzutowego lub
miejscowo zaawansowanego
raka piersi HER2-low
OD 1 LIPCA 2025 ROKU
Badanie DESTINY-Breast06
DESTINY-Breast06: Projekt badania1
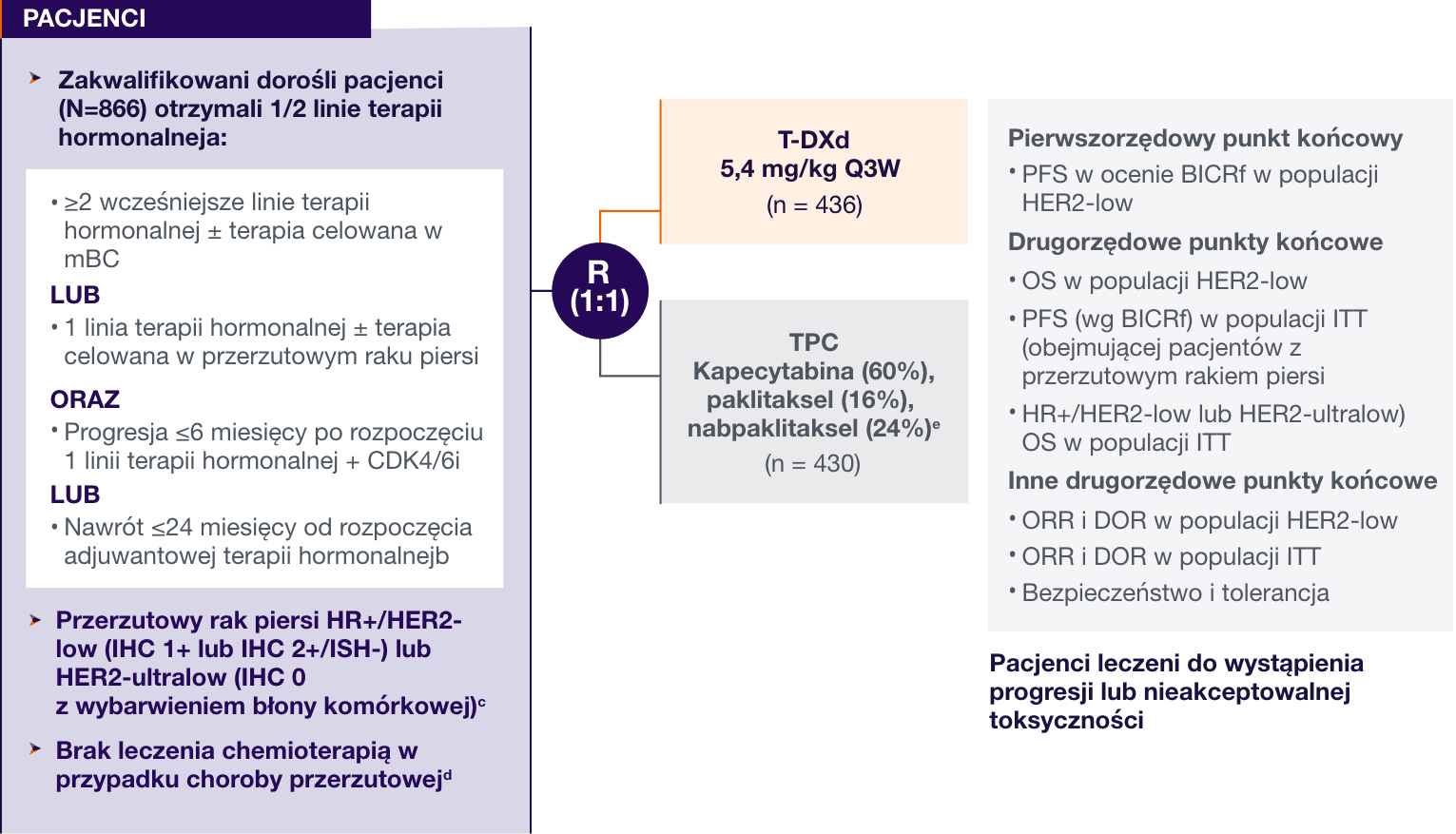
1. Bardia A, Hu X, Dent R, i wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086 aKryteria wykluczenia obejmowały ILD/niezakaźne zapalenie płuc w wywiadzie wymagające leczenia sterydami lub ILD/zapalenie płuc podczas badań przesiewowych, nieopanowaną lub poważną chorobę sercowo-naczyniową, nieleczone i objawowe przerzuty do mózgu lub sprawność fizyczną według skali ECOG. bWymagana tylko 1 linia terapii hormonalnej w przypadku przerzutów. cZgodnie z PATHWAY/VENTANA anty-HER2/neu (4B5) ocenianym w laboratorium centralnym. HER2-ultralow zdefiniowano jako słabe, częściowe wybarwienie błony komórkowej w ≤10% komórek nowotworowych (znane również jako IHC >0<1+). dPacjentki mogły być poddane chemioterapii w ramach leczenia neoadiuwantowego lub adiuwantowego, o ile okres przerwy w chorobie wynosił >12 miesięcy. eW ramieniu kontrolnym pacjentki otrzymywały leczenie według wyboru lekarza: 60% pacjentek otrzymywało kapecytabinę, 24% nab-paklitaksel, a 16% paklitaksel. fPFS na podstawie RECIST v1.1.
DESTINY-Breast06: Wyjściowa charakterystyka kliniczna pacjentów HER2-low1
~2/3 pacjentów otrzymało wcześniej 2 linie leczenia ET w chorobie przerzutowej.1
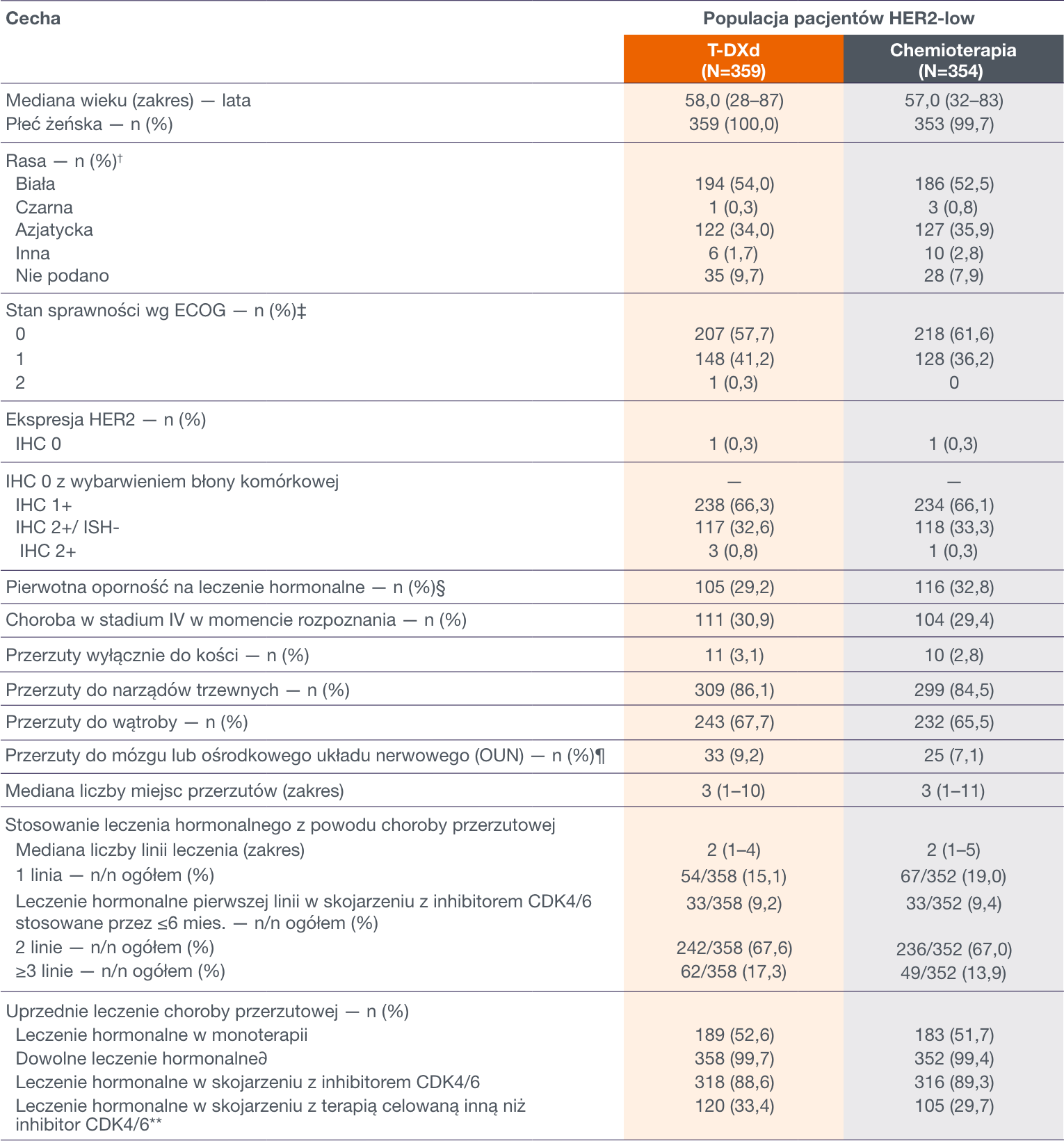
1.Bardia A, Hu X, Dent R, i wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086 *Populacja z niską ekspresją receptora ludzkiego naskórkowego czynnika wzrostu (ang. human epidermal growth factor receptor 2, HER2) obejmowała pacjentów z niską ekspresją HER2 określaną na podstawie wyniku badania immunohistochemicznego (ang. immunohistochemical, IHC) wynoszącego 1+ lub 2+ oraz ujemnych wyników badania metodą hybrydyzacji in situ (ang. in situ hybridization, ISH). Populacja wyodrębniona zgodnie z zaplanowanym leczeniem obejmowała wszystkich zrandomizowanych pacjentów. W populacji z ultraniską ekspresją HER2 znalazły się pacjentki z ultraniską ekspresją HER2 określaną jako wynik IHC 0 z wybarwieniem błony komórkowej. Status niskiej i ultraniskiej ekspresji HER2 określano zgodnie z danymi pochodzącymi z laboratorium centralnego. Ze względu na błędy stratyfikacyjne łączna liczebność próby obejmująca obie populacje nie odpowiada liczbie chorych w populacji wyodrębnionej zgodnie z zaplanowanym leczeniem. Dwie pacjentki błędnie przypisano do populacji wyodrębnionej zgodnie z zaplanowanym leczeniem (po 1 do każdej grupy leczenia). Po przeprowadzeniu badań w laboratorium centralnym stwierdzono u nich HER2 IHC 0 bez wybarwienia błony komórkowej. Jedna pacjentka pierwotnie zakwalifikowana do populacji z ultraniską ekspresją HER2 została przypisana do populacji z niską ekspresją HER2 na podstawie wyniku oceny uaktualnionej biopsji (materiał oceniony w momencie przesiewu pobrano przed wystąpieniem choroby przerzutowej). Tym samym wspomniana pacjentka nie została uwzględniona w analizie populacji z ultraniską ekspresją HER2 ani w analizie pierwotnej populacji z niską ekspresją HER2; jej dane włączono do populacji wyodrębnionej zgodnie z zaplanowanym leczeniem. Schemat chemioterapii wybierał lekarz prowadzący spośród kapecytabiny, paklitakselu w postaci nanocząsteczkowego kompleksu z albuminą oraz paklitakselu. Wartości procentowe po zsumowaniu nie pozwalają uzyskać 100, co jest wynikiem zaokrąglenia. CDK4/6 oznacza kinazę zależną od cyklin 4 i 6. † Rasa była podawana przez pacjentów. ‡ Ocena stanu sprawności wg Eastern Cooperative Oncology Group (ECOG) jest wykonywana na 5-punktowej skali, gdzie wyższe oceny oznaczają większą niepełnosprawność. Łącznie u 14 pacjentów w populacji wyodrębnionej zgodnie z zaplanowanym leczeniem (5 pacjentek w grupie trastuzumabu derukstekanu i 9 chorych w grupie chemioterapii) nie miało informacji na temat stanu sprawności wg ECOG w punkcie wyjściowym; w ich przypadku wynik 0 lub 1 udokumentowano w ciągu 6 dni po przeprowadzeniu randomizacji. § Pierwotną oporność na leczenie hormonalne definiowano jako wystąpienie nawrotu choroby w ciągu pierwszych 2 lat od momentu rozpoczęcia hormonoterapii uzupełniającej lub wystąpienie progresji choroby w ciągu pierwszych 6 miesięcy od momentu rozpoczęcia leczenia hormonalnego pierwszej linii z powodu raka piersi z przerzutami. ¶ Z badania wyłączono pacjentów z klinicznie aktywnym przerzutem do ośrodkowego układu nerwowego (OUN) (określanym jako nieleczona choroba, choroba powodująca objawy lub wymagająca leczenia glikokortykosteroidami bądź lekami przeciwdrgawkowymi w celu kontroli objawów podmiotowych). ∂Dowolne leczenie hormonalne obejmowało leczenie podawane w monoterapii lub leczenie skojarzone. ** Inne leki celowane stosowane w grupach trastuzumabu derukstekanu i chemioterapii w populacji wyodrębnionej zgodnie z zaplanowanym leczeniem obejmowały inhibitory mTOR (ang. mammalian target of rapamycin) (stosowane u 23,9% chorych w grupie trastuzumabu derukstekanu i u 23,7% w grupie chemioterapii), inhibitory kinazy fosfoinozytydu 3 (odpowiednio u 5,5% i 2,8%) lub inhibitory polimerazy poli-adenozynodifosforanu rybozy (odpowiednio u 0,7% i 1,2% chorych).
DESTINY-Breast06: Wyjściowa charakterystyka kliniczna pacjentów HER2-low1
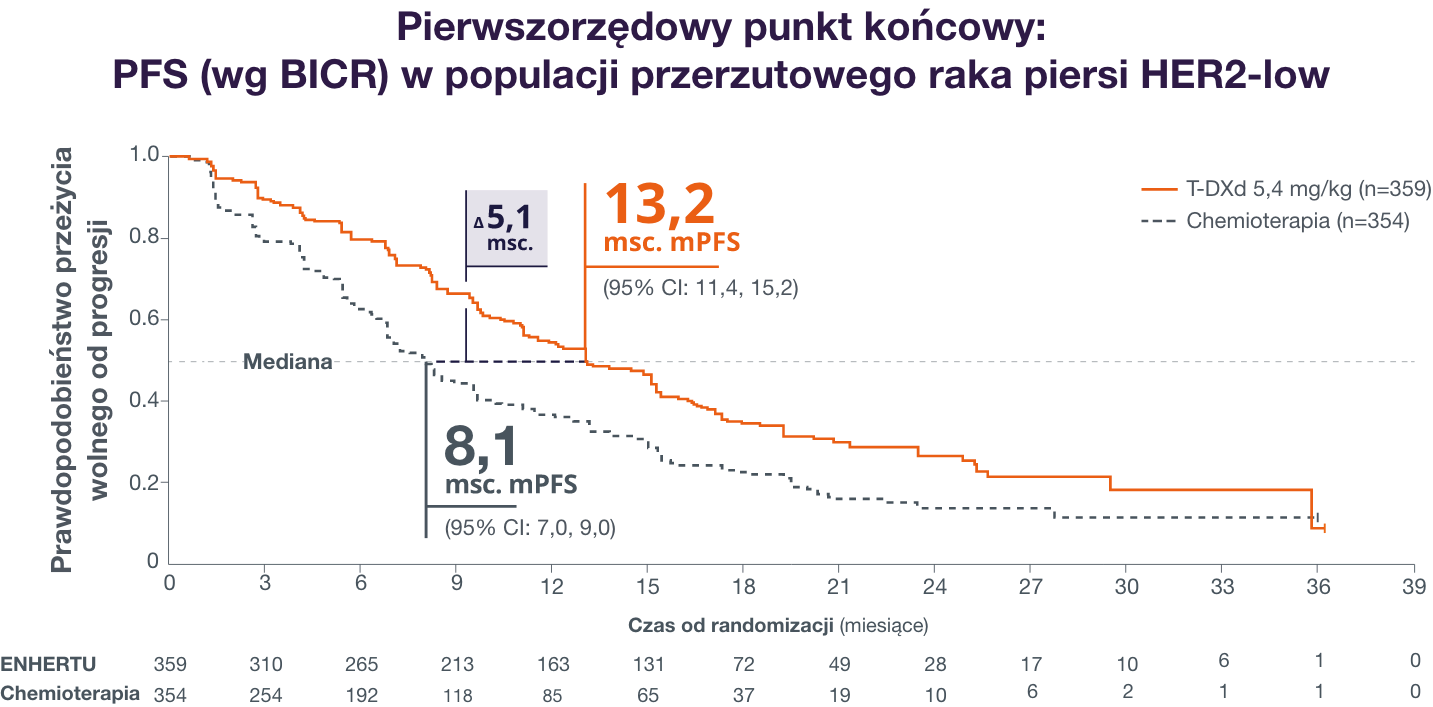
Redukcja ryzyka progresji choroby lub zgonu o 38% dzięki T-DXd w porównaniu z chemioterapią.1
1. Bardia A, Hu X, Dent R, et i wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086
Destiny-Breast06: Zaobserwowano spójne mPFS w badanych podgrupach1
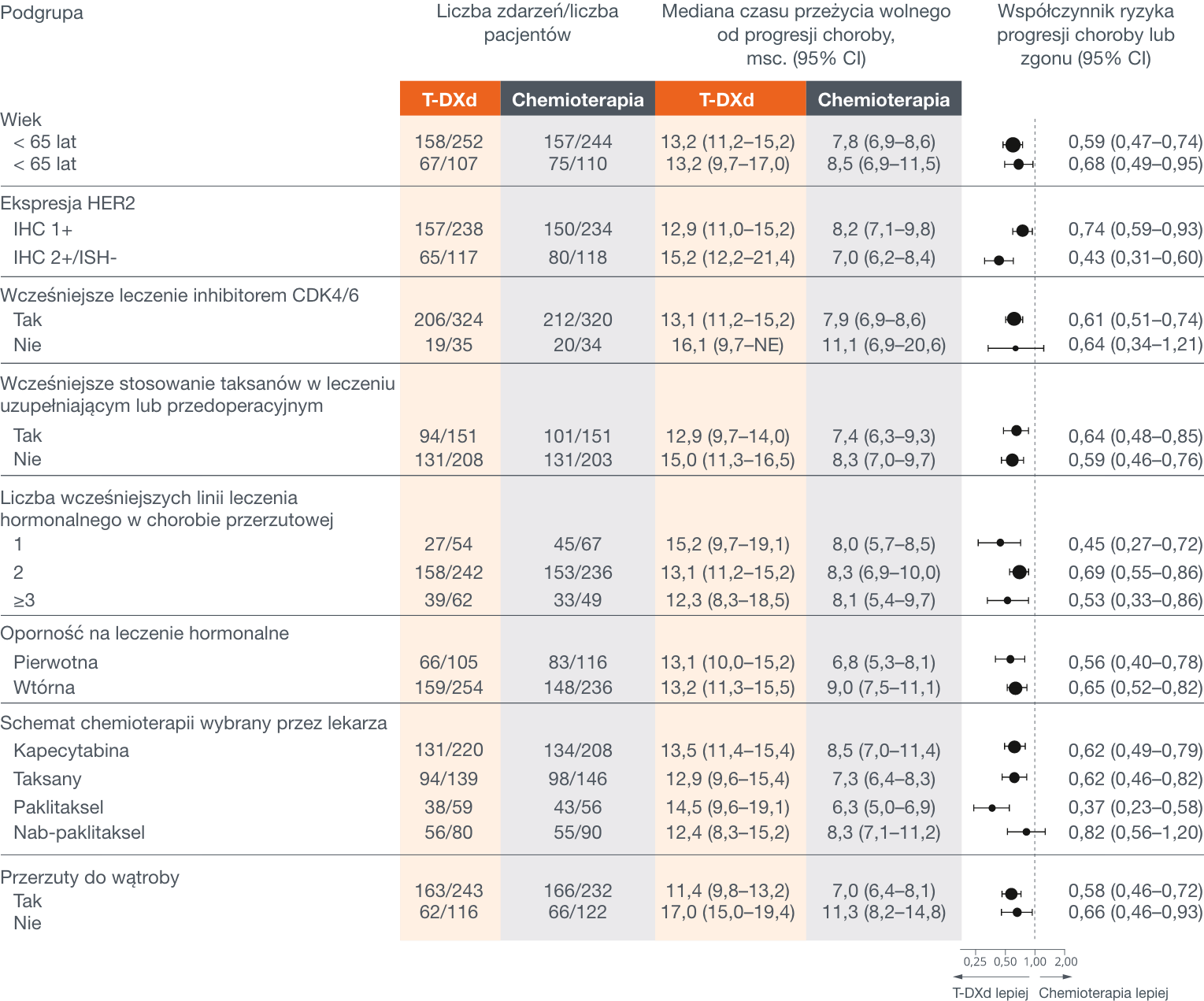
Ekspresję HER2 określano na podstawie danych z laboratorium centralnego (tj. wynik ostatniej oceny próbki materiału uzyskanego przed randomizacją). Pierwotną oporność na leczenie hormonalne zdefiniowano jako nawrót choroby, który wystąpił w ciągu pierwszych 2 lat od rozpoczęcia hormonoterapii uzupełniającej lub progresję choroby w ciągu pierwszych 6 miesięcy od rozpoczęcia leczenia hormonalnego pierwszej linii z powodu raka piersi z przerzutami stwierdzaną w trakcie leczenia. Wtórną (nabytą) oporność na leczenie hormonalne stwierdzano w przypadku nawrotu choroby występującego w trakcie przyjmowania hormonoterapii uzupełniającej, ale po 2 latach stosowania lub nawrotu występującego w ciągu 12 miesięcy po zakończeniu hormonoterapii uzupełniającej, bądź też w przypadku progresji choroby występującej powyżej 6 miesięcy od momentu rozpoczęcia leczenia hormonalnego z powodu raka piersi z przerzutami w trakcie leczenia. Schemat chemioterapii wybrany przez lekarza (kapecytabina, paklitaksel w postaci nanocząsteczkowego kompleksu z albuminą lub paklitaksel). Uwzględnienie taksanów w jednej grupie wykonano w ramach analizy post hoc. Wielkość kółek na wykresie jest proporcjonalna do liczby zdarzeń. CDK4/6 oznacza kinazę zależną od cyklin 4 i 6, a NE brak możliwości oceny
1.Bardia A, Hu X, Dent R, i wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086
1.Bardia A, Hu X, Dent R, i wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086
Destiny-Breast06: mPFS w zależności od czasu do progresji w 1L ET + CDK4/6i oraz rodzaju oporności na leczenie hormonalne
T-DXd wydłużyło mPFS w porównaniu do chemioterapii, niezależenie od czasu do progresji w 1L ET + CDK4/6i, czy też rodzaju oporności na leczenie hormonalne.
1. Cardoso F, et al. Ann Oncol. 2020;31:1623–1649 2. Bardia A. Abstract LB1-04 presented during San Antonio Breast Cancer Symposium (December 10–13, 2024)
*Analiza TTP (czasu do progresji) uwzględniała 570 pacjentów z progresją na wcześniejszej 1L ET + CDK4/6i (65.8% populacji ITT); Pierwotna oporność na leczenie hormonalne była definiowana jako nawrót w ciągu pierwszych dwóch lat uzupełniającej ET lub progresja poniżej 6 miesięcy od rozpoczęcia 1L ET w przerzutowym raku piersi. Wtórna (nabyta) oporność na leczenie hormonalne była definiowana jako nawrót po pierwszych dwóch latach uzupełniającej ET lub nawrót w przeciągu 12 miesięcy od zakończenia uzupełniającej ET lub progresja powyżej 6 miesięcy od rozpoczęcia ET w przerzutowym raku piersi.
*Analiza TTP (czasu do progresji) uwzględniała 570 pacjentów z progresją na wcześniejszej 1L ET + CDK4/6i (65.8% populacji ITT); Pierwotna oporność na leczenie hormonalne była definiowana jako nawrót w ciągu pierwszych dwóch lat uzupełniającej ET lub progresja poniżej 6 miesięcy od rozpoczęcia 1L ET w przerzutowym raku piersi. Wtórna (nabyta) oporność na leczenie hormonalne była definiowana jako nawrót po pierwszych dwóch latach uzupełniającej ET lub nawrót w przeciągu 12 miesięcy od zakończenia uzupełniającej ET lub progresja powyżej 6 miesięcy od rozpoczęcia ET w przerzutowym raku piersi.
Destiny-Breast06: T-DXd osiągnęło w podgrupie HER2-low ORR na poziomie 56,5% w porównaniu do 32,2% w grupie chemioterapii1
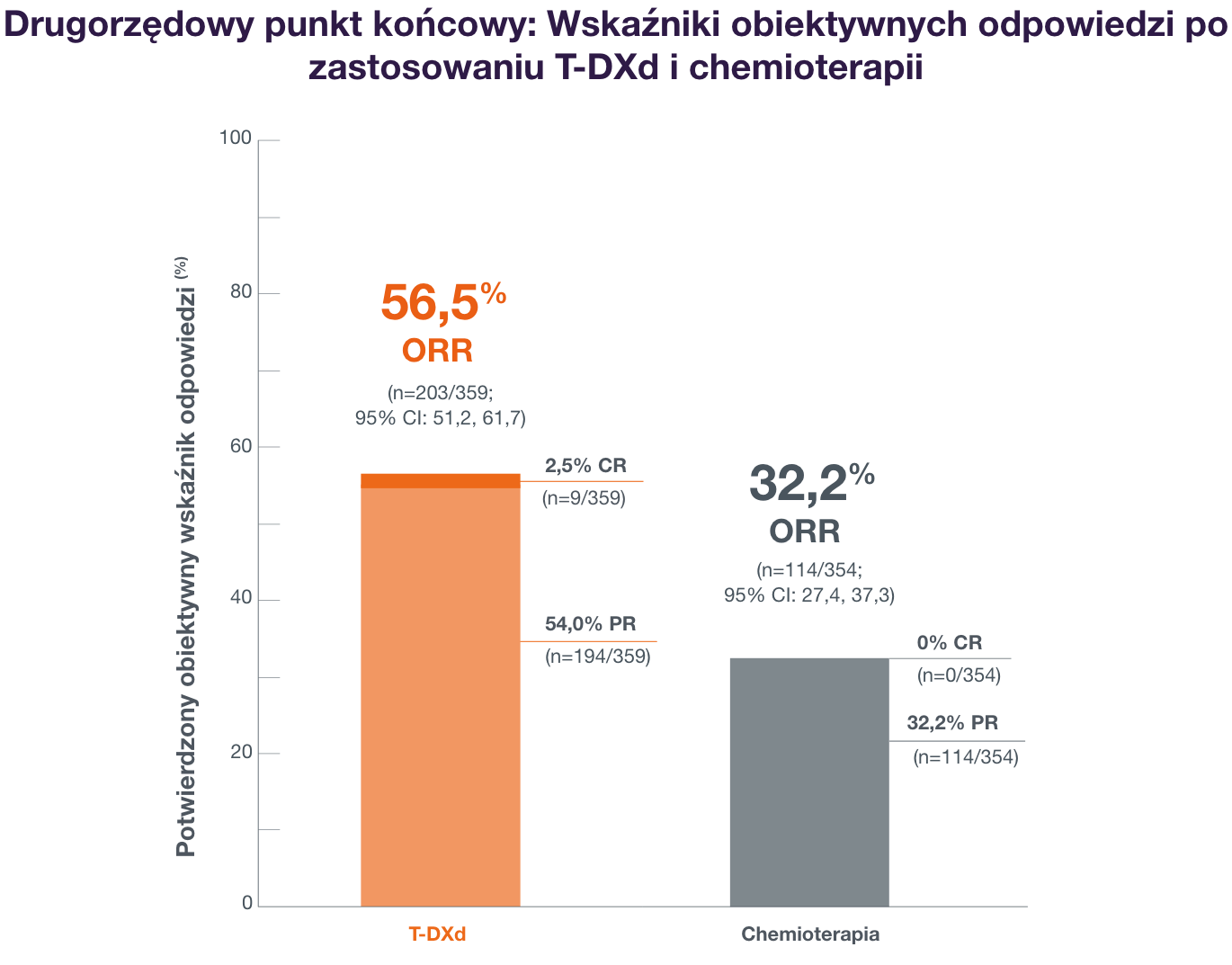
Mediana czasu trwania odpowiedzi na leczenie (mDOR) w przypadku T-DXd wyniosła 14,1 miesiąca w porównaniu do 8,6 miesiąca w grupie leczonej chemioterapią.1
ORR i DOR nie były testowane pod kątem istotności statystycznej, a badanie nie obejmowało wykazania różnic między ramionami leczenia.
1. Bardia A, Hu X, Dent R, I wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086
1. Bardia A, Hu X, Dent R, I wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086
Destiny-Breast06: nie zaobserwowano nowych sygnałów dotyczących profilu bezpieczeństwa T-DXd1
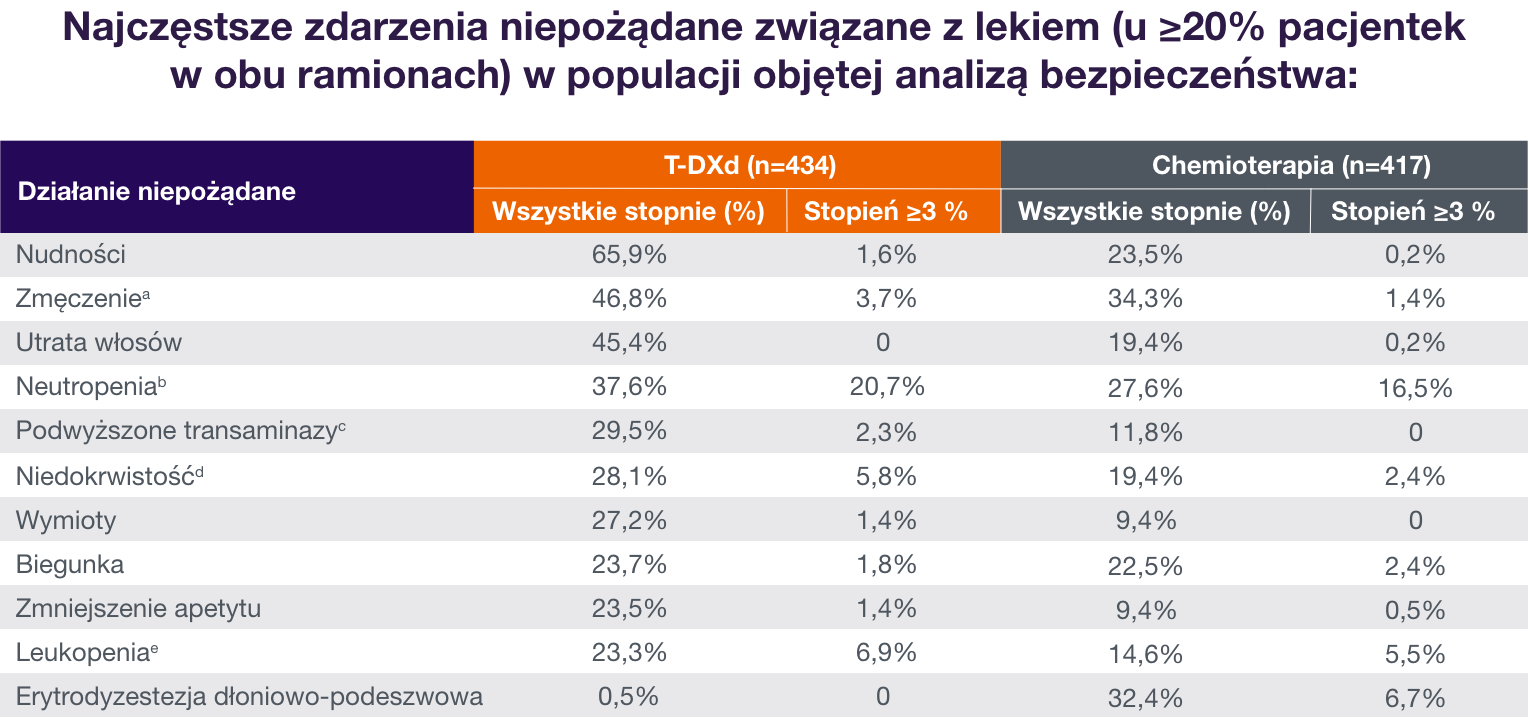
Ogólny odsetek działań niepożądanych związanych z lekiem stopnia ≥3 wynosił 40,6% przy zastosowaniu T-DXd i 31,4% przy zastosowaniu chemioterapii2
Mediana czasu trwania leczenia wynosiła 11 miesięcy (zakres: 0,4-39,6) przy zastosowaniu T-DXd i 5,6 miesiąca (zakres: 0,1- 35,9) przy zastosowaniu chemioterapii2
Mediana czasu trwania leczenia wynosiła 11 miesięcy (zakres: 0,4-39,6) przy zastosowaniu T-DXd i 5,6 miesiąca (zakres: 0,1- 35,9) przy zastosowaniu chemioterapii2
1. Bardia A, Hu X, Dent R, i wsp.; DESTINY-Breast06 Trial Investigators. Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086 2. Bardia A, Hu X, Dent R, i wsp.; DESTINY-Breast06 Trial Investigators. Supplement to: Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086 aObejmuje zmęczenie, osłabienie, złe samopoczucie i senność. bObejmuje obniżoną liczbę neutrofili i neutropenię. cObejmuje podwyższenie aktywności aminotransferaz, podwyższenie aktywności aminotransferazy asparaginianowej, podwyższenie aktywności aminotransferazy alaninowej, podwyższenie aktywności gamma-glutamylotransferazy, nieprawidłowy wynik testu czynności wątroby i podwyższony wynik testu czynności wątroby. dObejmuje zmniejszenie stężenia hemoglobiny, zmniejszenie liczby czerwonych krwinek, niedokrwistość i spadek hematokrytu. eObejmuje zmniejszenie liczby białych krwinek i leukopenię.
Destiny-Breast06: T-DXd zapewniało utrzymanie ogólnej jakości życia i funkcjonowania u pacjentek z przerzutowym rakiem piersi HR+/HER2-low i HER2-ultralow1
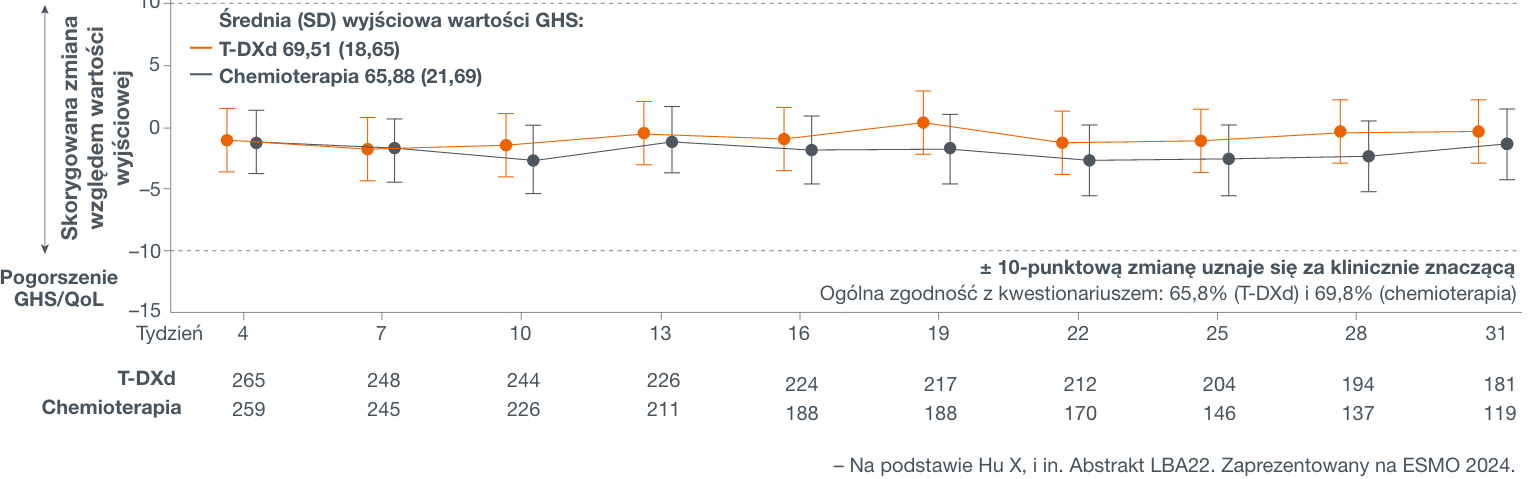
Stosowanie T-DXd pozwoliło podtrzymać ogólną jakość życia w podobnym stopniu jak chemioterapia u pacjentek z przerzutowym rakiem piersi HR+/HER2-low i HER2-ultralow. Objawy żołądkowo-jelitowe, w tym nudności i wymioty, nie wydawały się mieć negatywnego wpływu na jakość życia w ramieniu T-DXd.
Czas do pogorszenia jakości życia był podobny w przypadku stosowania T-DXd i chemioterapii; czas do pogorszenia funkcjonowania i wystąpienia dolegliwości bólowych był dłuższy w porównaniu z chemioterapią.
Czas do pogorszenia jakości życia był podobny w przypadku stosowania T-DXd i chemioterapii; czas do pogorszenia funkcjonowania i wystąpienia dolegliwości bólowych był dłuższy w porównaniu z chemioterapią.
Słupki przedstawiają 95% przedziały ufności. Wartość wyjściową rozumie się jako ostatnią ocenę przeprowadzoną w dniu randomizacji lub przed nim, lub przed podaniem pierwszej dawki, jeśli ocena dostępna była dopiero po randomizacji. 1. Hu X, Curigliano G, Yonemori K, I wsp; DESTINY-Breast06 Investigators. Effects of trastuzumab deruxtecan vs choice of chemotherapy on patient-reported outcomes in hormone-receptor–positive, HER2-low or HER2-ultralow metastatic breast cancer: results from DESTINY-Breast06 [abstract LBA22]. Presented at: European Society for Medical Oncology; September 13-17, 2024; Barcelona, Spain.
Kluczowe różnice pomiędzy badaniami DESTINY-Breast04 i DESTINY-Breast06

1. Modi S. i wsp. Zaprezentowano na: Europejskim Towarzystwie Onkologii Klinicznej 2023; 20–24 października 2023; Madryt, Hiszpania. Prezentacja 376O. 2. Bardia A, Hu X, Dent R, i wsp. DESTINY-Breast06 Trial Investigators.
Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086
*W badaniu DESTINY-BreastO6 u n=14 pacjentek brakowało wyjściowej wartości stanu sprawności fizycznej w skali ECOG. †Obejmuje preferowane terminy: obniżona liczba neutrofili i neutropenia.
Trastuzumab deruxtecan after endocrine therapy in metastatic breast cancer. N Engl J Med. 2024. doi:10.1056/NEJMoa2407086
*W badaniu DESTINY-BreastO6 u n=14 pacjentek brakowało wyjściowej wartości stanu sprawności fizycznej w skali ECOG. †Obejmuje preferowane terminy: obniżona liczba neutrofili i neutropenia.