Informacje o produkcie leczniczym Calquence®

Przewlekła białaczka limfocytowa
Badanie ELEVATE-TN: Calquence® – skuteczna monoterapia dla kontroli PBL.
74,5 miesiąca obserwacji i skuteczność niezależna od czynników ryzyka1
Skuteczność akalabrutynibu w badaniu ELEVATE TN — PFS
w ocenie badacza
-
Mediana PFS nie została osiągnięta dla A+O i A vs 27,8 miesiąca dla O+Clb. Szacowany 72-miesięczny odsetek PFS wyniósł 78% dla A+O, 62% dla A w monoterapii i 17% dla O+Clb.
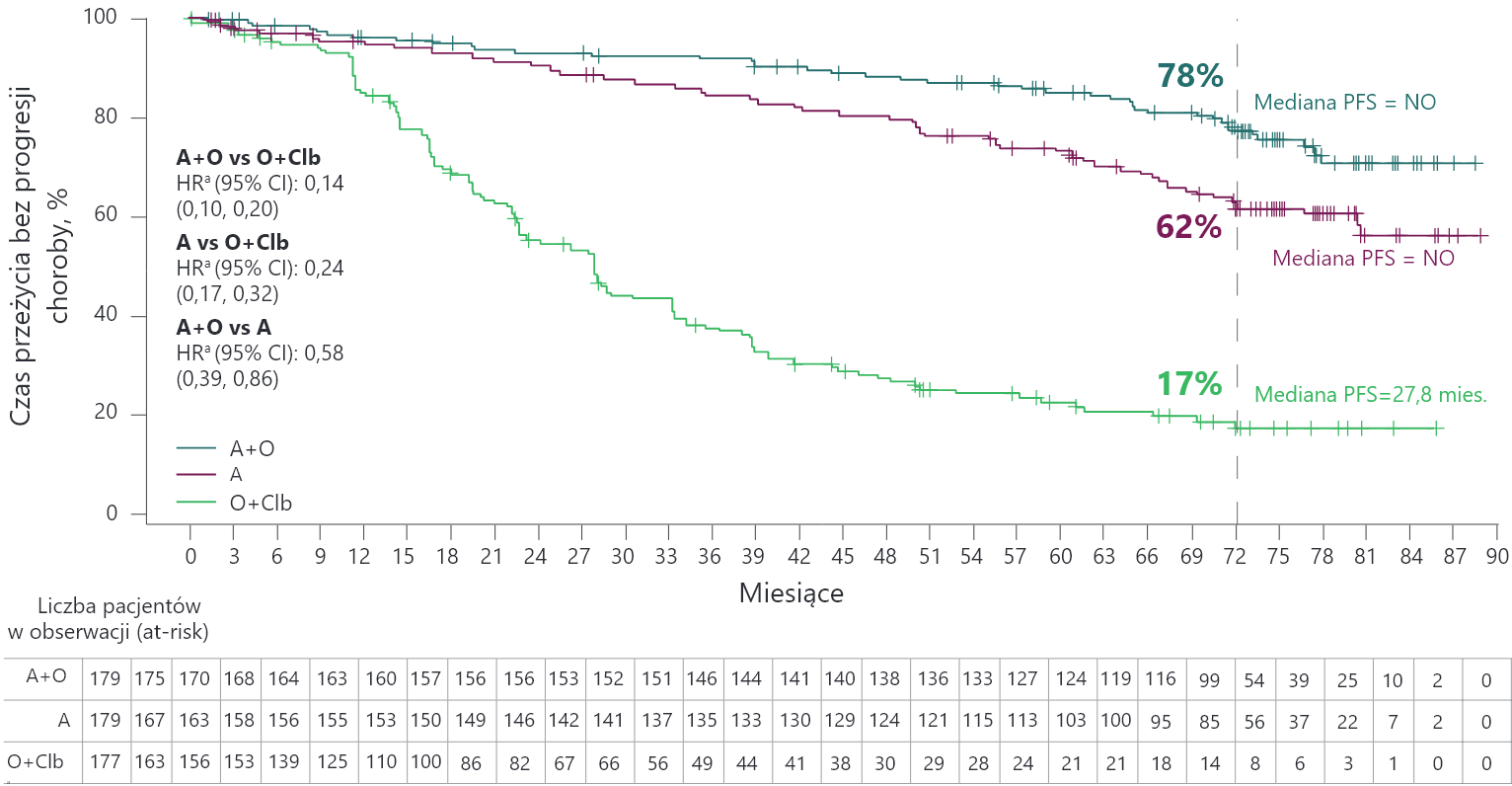
a Współczynnik ryzyka na podstawie modelu proporcjonalnego ryzyka Coxa bez stratyfikacji.
A = akalabrutynib; CI (ang. confidence interval) = przedział ufności; Clb = chlorambucyl; HR (ang. hazard ratio) = współczynnik ryzyka; NO = nie osiągnięto; O = obinutuzumab; PFS (ang. progression-free survival) = czas przeżycia bez progresji choroby; vs = w porównaniu z.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
A = akalabrutynib; CI (ang. confidence interval) = przedział ufności; Clb = chlorambucyl; HR (ang. hazard ratio) = współczynnik ryzyka; NO = nie osiągnięto; O = obinutuzumab; PFS (ang. progression-free survival) = czas przeżycia bez progresji choroby; vs = w porównaniu z.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
Skuteczność akalabrutynibu w badaniu ELEVATE-TN
– 80% pacjentów odpowiada na leczenie już po 3 miesiącach1
-
Oceniane przez badacza odsetki ORR i CR/CRi wyniosły 96% w ramieniu A+O (95% CI: 92–98) i 90% w ramieniu A (95% CI: 85-94), vs 83% w ramieniu O+Clb (95% CI: 77–88).
-
Łączny odsetek ORR i CR/CRi w ocenie badacza wyniósł 37% w przypadku A+O i 19% w przypadku A vs 14% w przypadku O+Clb.
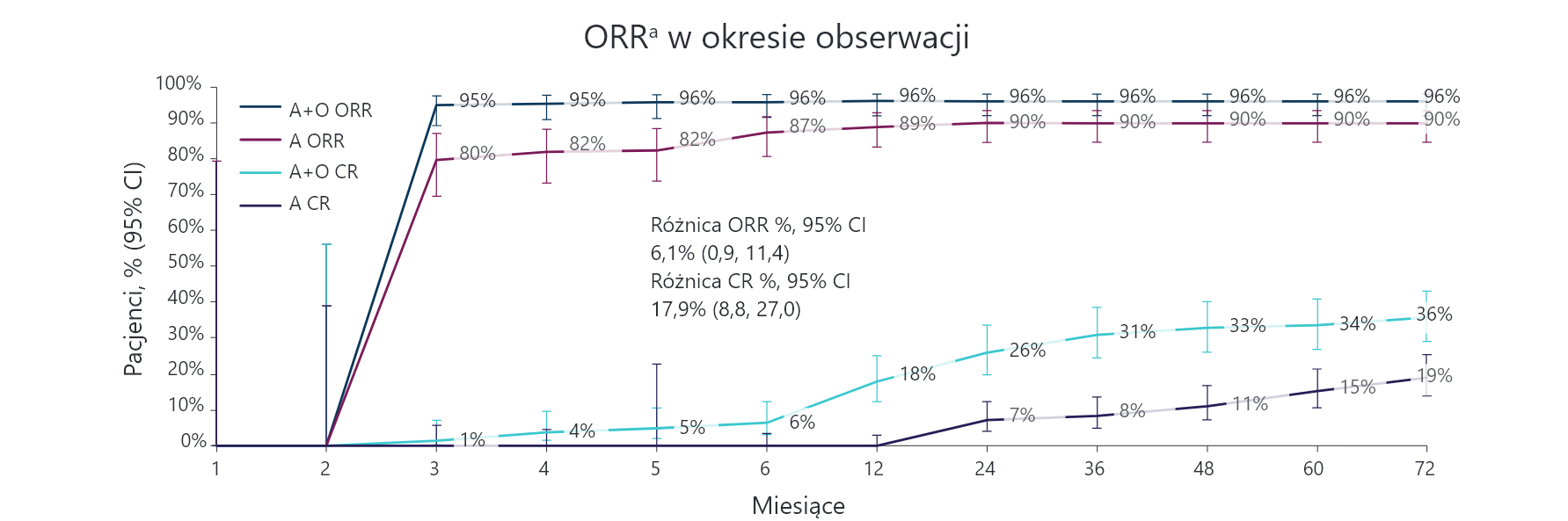
a ORR zdefiniowano jako osiągnięcie CR, CRi, nPR lub PR w ocenie badacza zgodnie z kryteriami iwCLL 2008 w momencie lub przed rozpoczęciem kolejnej terapii przeciwnowotworowej.
ORR nie obejmuje PRL.
A = akalabrutynib; CI (ang. confidence interval) = przedział ufności; Clb = chlorambucyl; CR (ang. complete response) = odpowiedź całkowita; CRi (ang. complete response with incomplete blood count recovery) = całkowita odpowiedź z niepełną regeneracją hematologiczną; iwCLL (ang. International Workshop on Chronic Lymphocytic Leukemia) = międzynarodowe warsztaty dotyczące przewlekłej białaczki limfocytowej; nPR (ang. nodular partial response) = częściowa odpowiedź ze strony węzłów chłonnych; O = obinutuzumab; ORR (ang. overall response rate) = całkowity odsetek odpowiedzi na leczenie; PR (ang. partial response) = częściowa odpowiedź na leczenie; PRL (ang. partial response with lymphocytosis) = odpowiedź częściowa z limfocytozą; vs = w porównaniu z.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
ORR nie obejmuje PRL.
A = akalabrutynib; CI (ang. confidence interval) = przedział ufności; Clb = chlorambucyl; CR (ang. complete response) = odpowiedź całkowita; CRi (ang. complete response with incomplete blood count recovery) = całkowita odpowiedź z niepełną regeneracją hematologiczną; iwCLL (ang. International Workshop on Chronic Lymphocytic Leukemia) = międzynarodowe warsztaty dotyczące przewlekłej białaczki limfocytowej; nPR (ang. nodular partial response) = częściowa odpowiedź ze strony węzłów chłonnych; O = obinutuzumab; ORR (ang. overall response rate) = całkowity odsetek odpowiedzi na leczenie; PR (ang. partial response) = częściowa odpowiedź na leczenie; PRL (ang. partial response with lymphocytosis) = odpowiedź częściowa z limfocytozą; vs = w porównaniu z.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
ELEVATE-TN: Calquence® – korzyści w podgrupach wysokiego ryzyka (uIGHV, del(17p) i/lub mutTP53) przy zachowaniu dobrej tolerancji terapii1
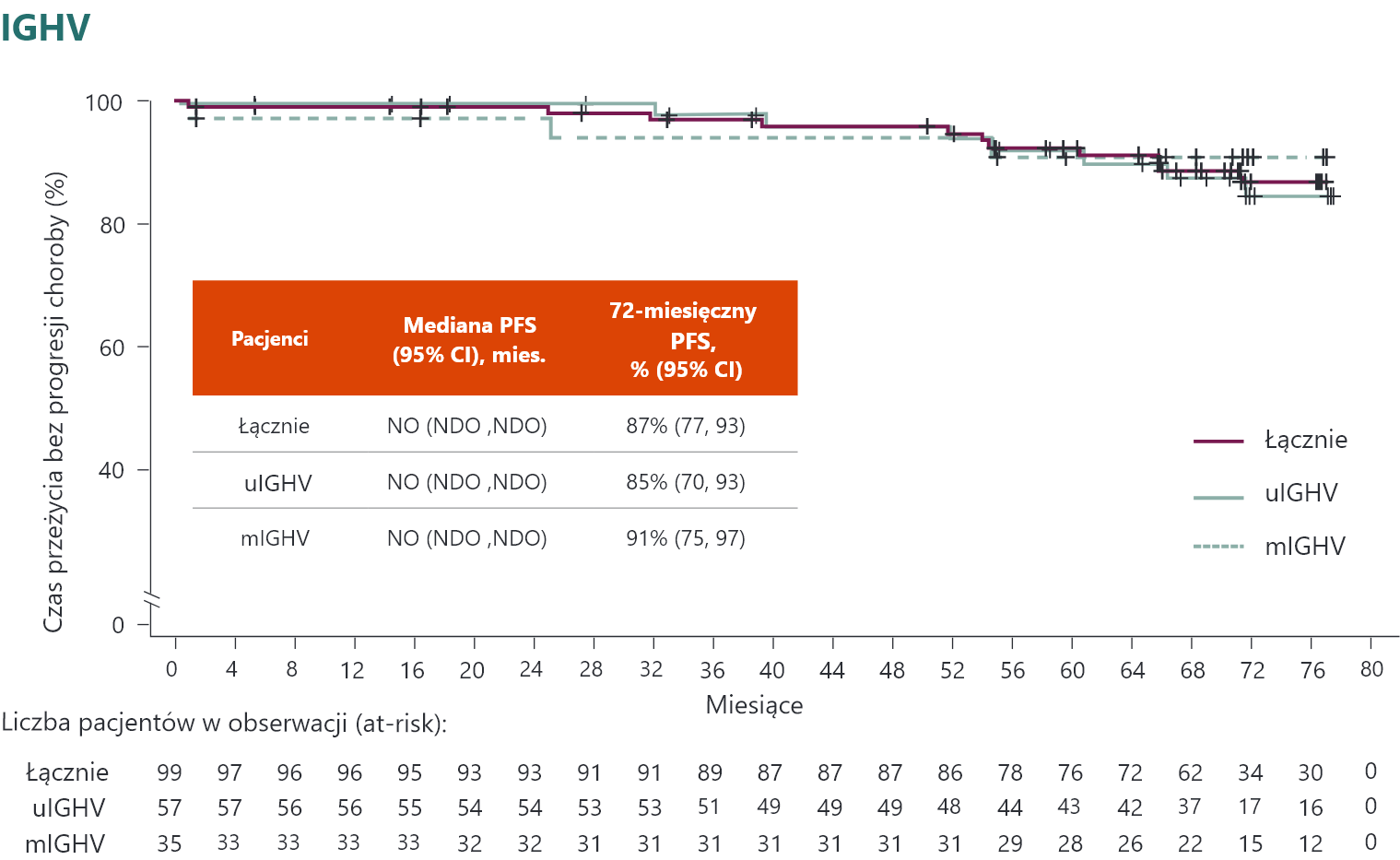
PFS w ocenie badacza u pacjentów z uIGHV
-
Odsetek PFS u pacjentów leczonych A z uIGHV był zgodny z odsetkiem PFS w populacji leczonej A z mIGHV.
-
Mediana PFS nie została osiągnięta u pacjentów z uIGHV leczonych A+O i A w porównaniu z 22,2 miesiąca w ramieniu O+Clb.
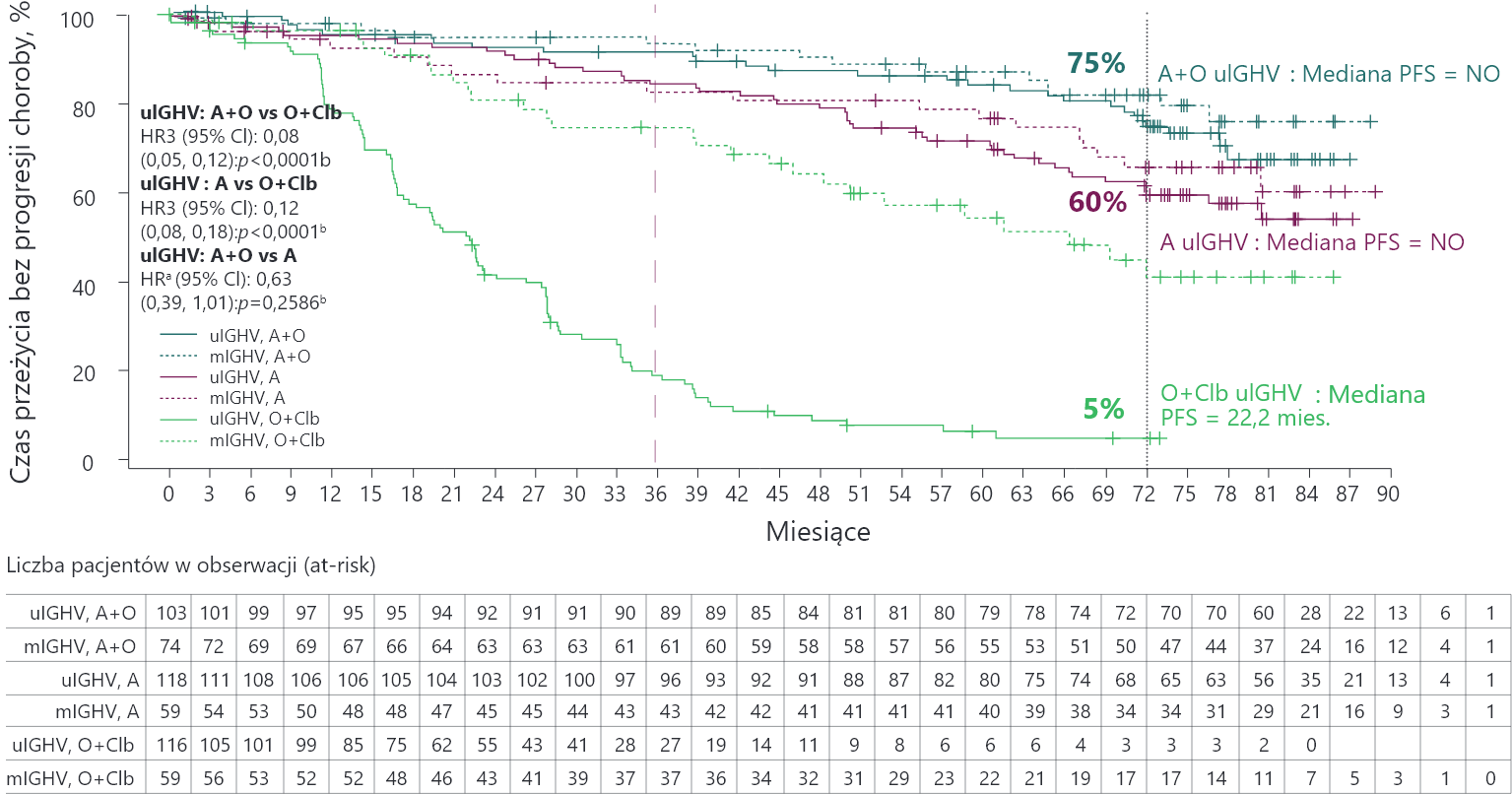
a Współczynnik ryzyka ustalono na podstawie modelu proporcjonalnego ryzyka Coxa bez stratyfikacji.
A = akalabrutynib; CI (ang. confidence interval) = przedział ufności; Clb = chlorambucyl; HR (ang. hazard ratio) = współczynnik ryzyka; IGHV (ang. immunoglobulin heavy chain variable) = region zmienny łańcucha ciężkiego immunoglobulin; mIGHV = zmutowany IGHV; NO = nie osiągnięto; O = obinutuzumab; PFS (ang. progression free survival) = czas przeżycia bez progresji choroby; uIGHV = niezmutowany IGHV; vs = w porównaniu z.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
A = akalabrutynib; CI (ang. confidence interval) = przedział ufności; Clb = chlorambucyl; HR (ang. hazard ratio) = współczynnik ryzyka; IGHV (ang. immunoglobulin heavy chain variable) = region zmienny łańcucha ciężkiego immunoglobulin; mIGHV = zmutowany IGHV; NO = nie osiągnięto; O = obinutuzumab; PFS (ang. progression free survival) = czas przeżycia bez progresji choroby; uIGHV = niezmutowany IGHV; vs = w porównaniu z.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
PFS w ocenie badacza u pacjentów z del(17p) i/lub mutacją TP53
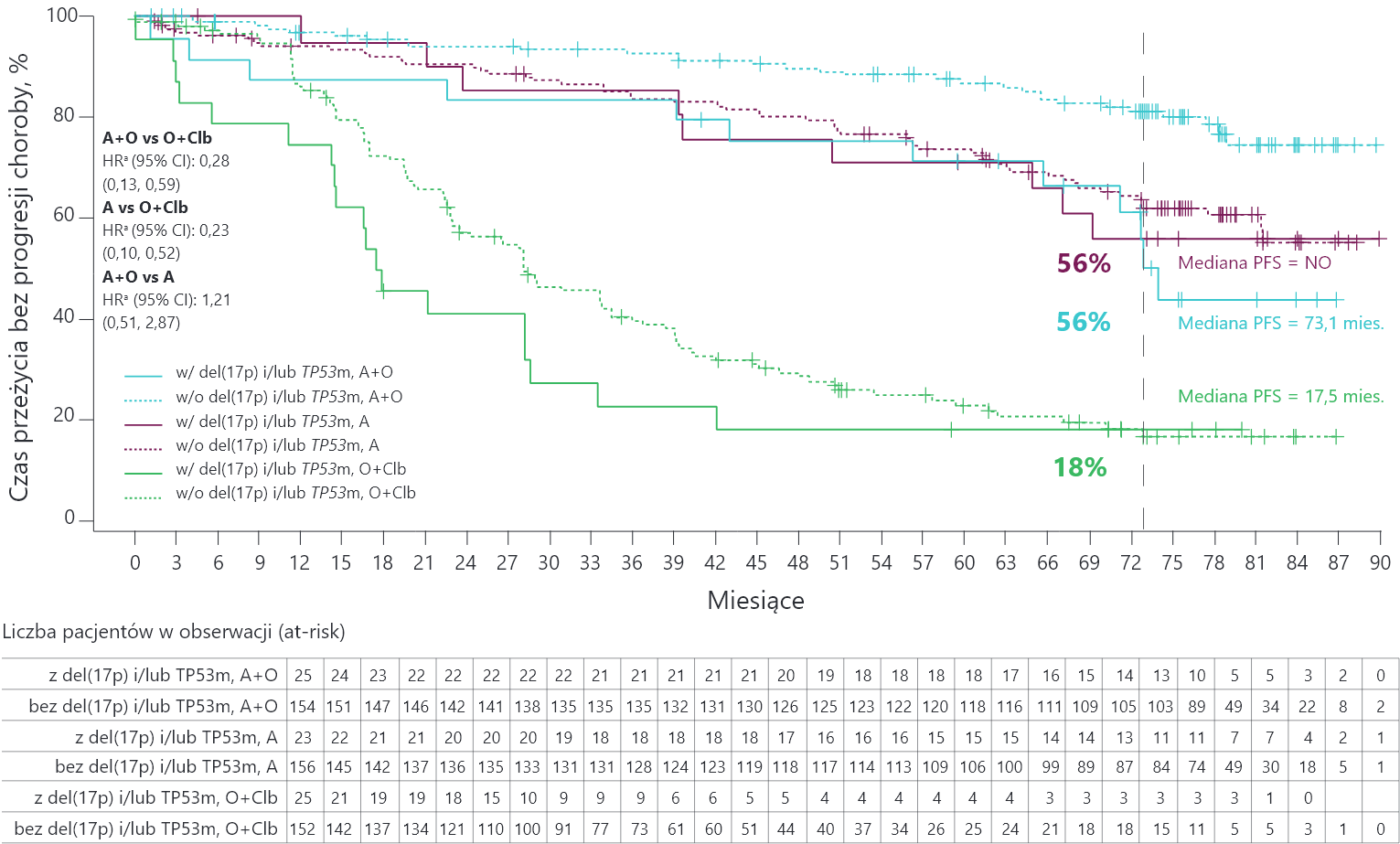
Mediana PFS była istotnie dłuższa u pacjentów z del(17p) i/lub TP53m leczonych A niż u pacjentów otrzymujących O+Clb.
a Współczynnik ryzyka na podstawie modelu proporcjonalnego ryzyka Coxa bez stratyfikacji. A = akalabrutynib; CI (ang. confidence interval) = przedział ufności; Clb = chlorambucyl; HR (ang. hazard ratio) = współczynnik ryzyka; NO = nie osiągnięto; O = obinutuzumab; PFS (ang. progression free survival) = czas przeżycia bez progresji choroby; TP53 (ang. tumour protein p53) = białko nowotworowe p53; vs = w porównaniu z.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
Długotrwała skuteczność i bezpieczeństwo1
Bezpieczeństwo: najczęstsze AE u ≥5% pacjentów
-
Najczęściej zgłaszanymi zdarzeniami niepożądanymi były: biegunka (43,8% [A+O] i 42,5% [A], ból głowy (40,4% [A+O] i 39,1% [A]) oraz bóle stawów (36,0% [A+O] i 27,4 [A]).
-
Profil najczęściej występujących zdarzeń niepożądanych był zgodny z wynikami wcześniejszych analiz.
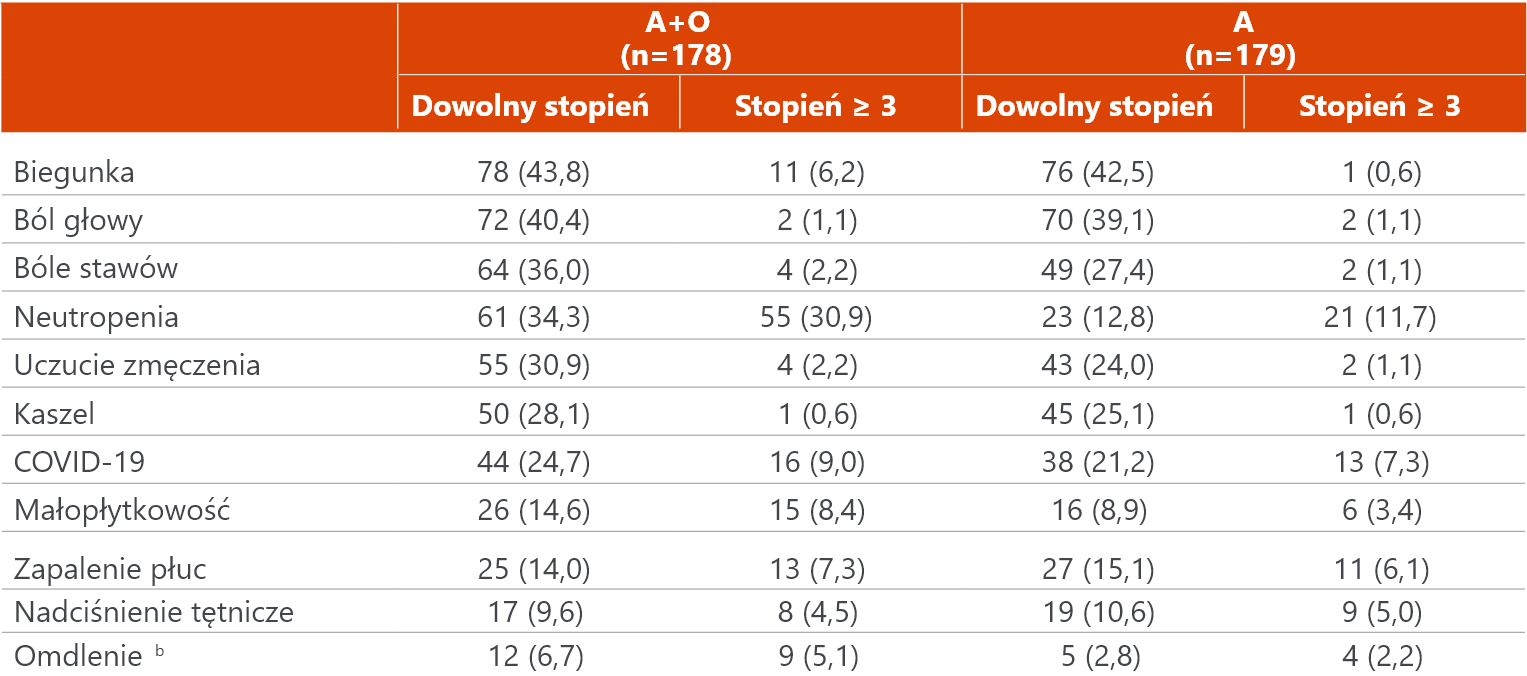
Dane wyrażone jako n (%), o ile nie wskazano inaczej.
a Zdarzenia niepożądane dowolnego stopnia u ≥30% pacjentów leczonych akalabrutyniebem lub stopnia ≥3 u ≥5% pacjentów leczonych akalabrutynibem.
b Zdarzenia związane z omdleniami sercowymi były zgłaszane oddzielnie.
A = akalabrutynib; Clb = chlorambucyl; O = obinutuzumab.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
a Zdarzenia niepożądane dowolnego stopnia u ≥30% pacjentów leczonych akalabrutyniebem lub stopnia ≥3 u ≥5% pacjentów leczonych akalabrutynibem.
b Zdarzenia związane z omdleniami sercowymi były zgłaszane oddzielnie.
A = akalabrutynib; Clb = chlorambucyl; O = obinutuzumab.
Sharman J.P. i wsp. Prezentacja ustna podczas: ASH; 9–12 grudnia 2023 r.; San Diego.
Badanie CLL–FRAIL: Calquence® – skuteczność i bezpieczeństwo potwierdzone u pacjentów w podeszłym wieku i/lub z zespołem kruchości2
Badanie CLL–FRAIL: Calquence® – efektywność wykraczająca poza samą kontrolę choroby2
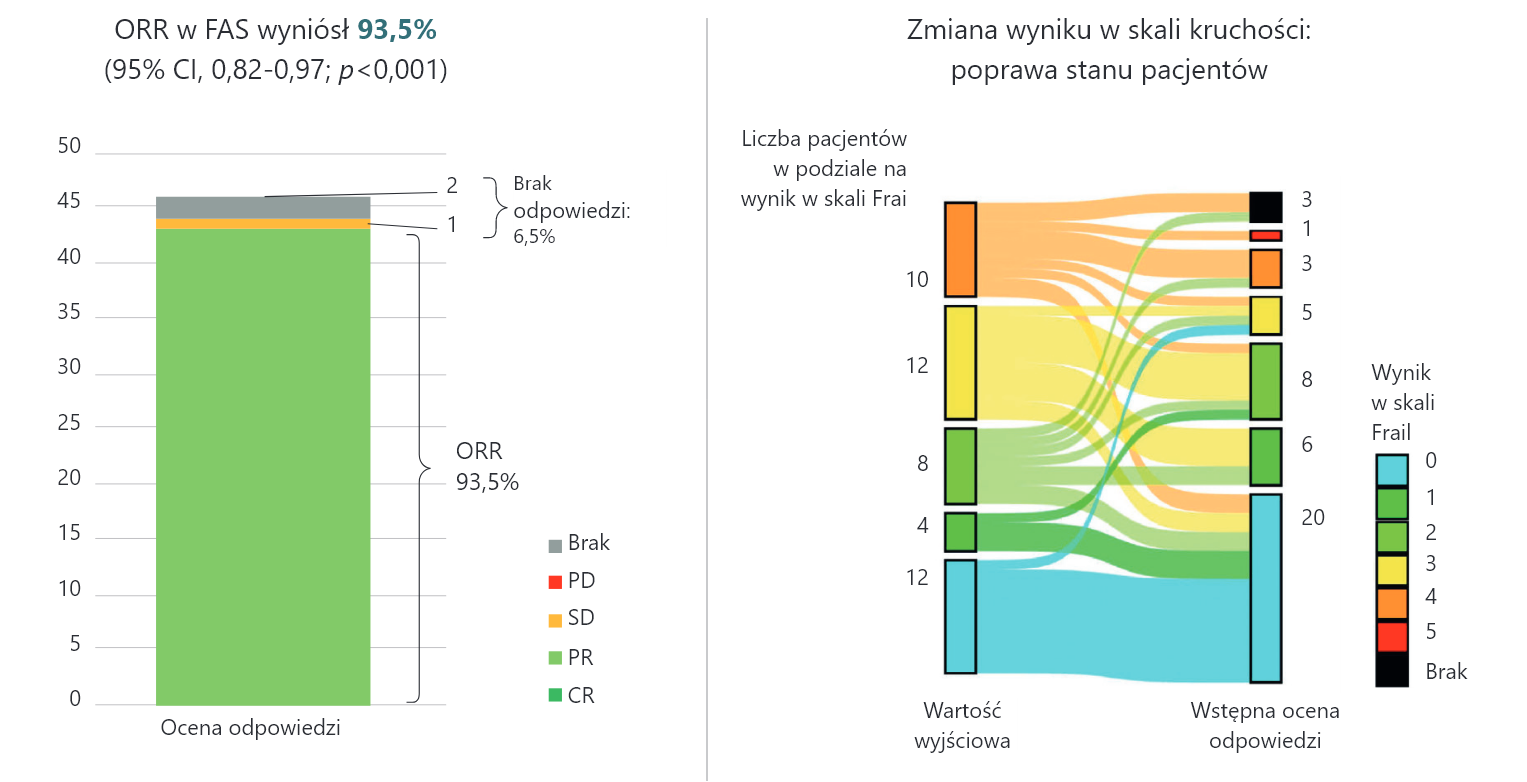
CR – odpowiedź całkowita; FAS – zestaw pełnej analizy; ORR – całkowity odsetek odpowiedzi; PD – progresja choroby; PR – odpowiedź częściowa; SD – stabilny przebieg choroby.
Badanie CLL–FRAIL: Calquence® – skuteczność i bezpieczeństwo w jednym2
W analizie OS wśród pacjentów w FAS nie osiągnięto mediany OS. Szacowany 12-miesięczny odsetek OS wyniósł 95,7%3
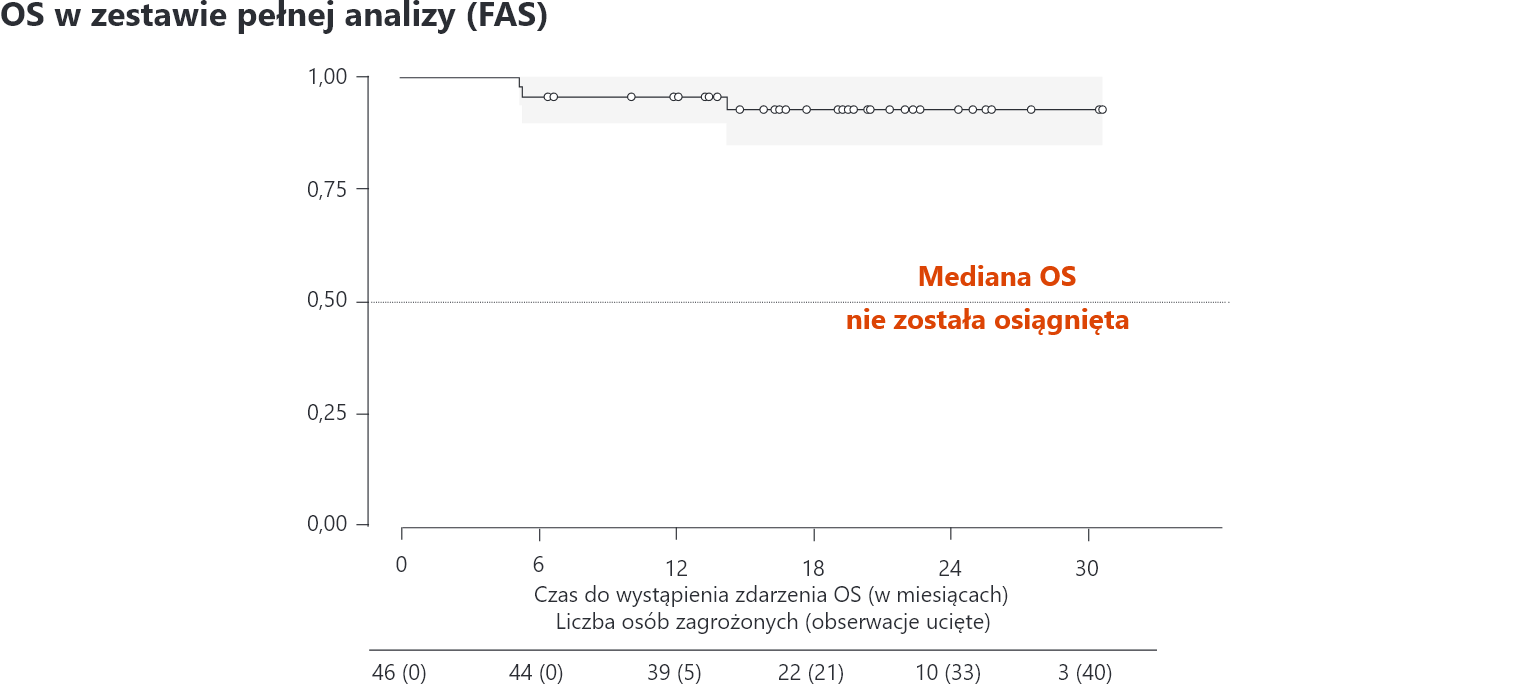
FAS – pełny zestaw do analizy; OS – przeżycie całkowite.
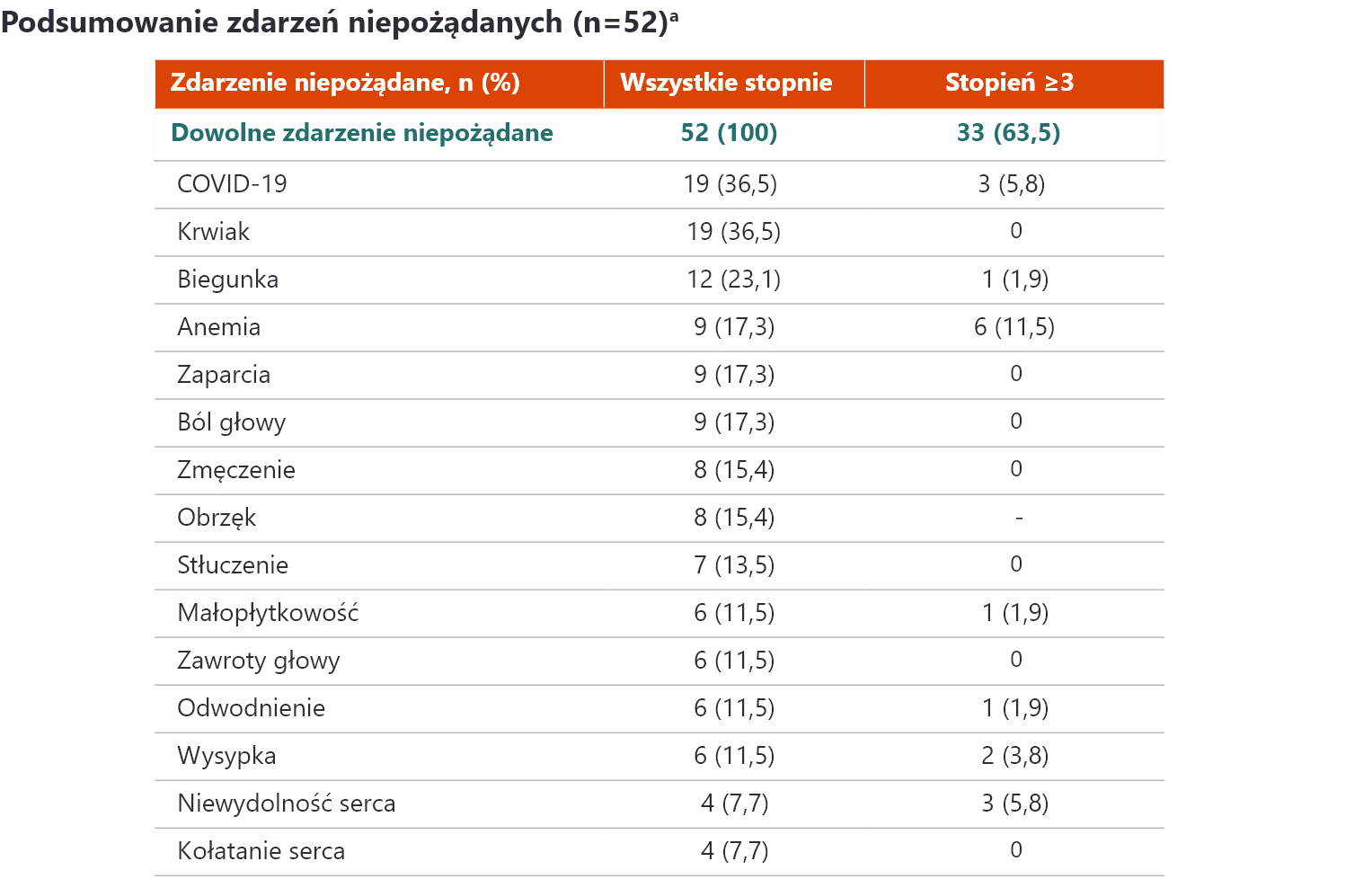
a Analizy na poziomie pacjentów były przeprowadzane dla pacjentów, wśród których występowanie wynosiło co najmniej 10%. Zobrazowano tylko częste zdarzenia
niepożądane (≥10% pacjentów) i zdarzenia kardiologiczne. COVID-19 – koronawirus 2019.
niepożądane (≥10% pacjentów) i zdarzenia kardiologiczne. COVID-19 – koronawirus 2019.
Badanie ACE–CL–001: Calquence® – długotrwała
skuteczność w monoterapii PBL3,4
Badanie ACE–CL–001: charakterystyka wyjściowa pacjentów4
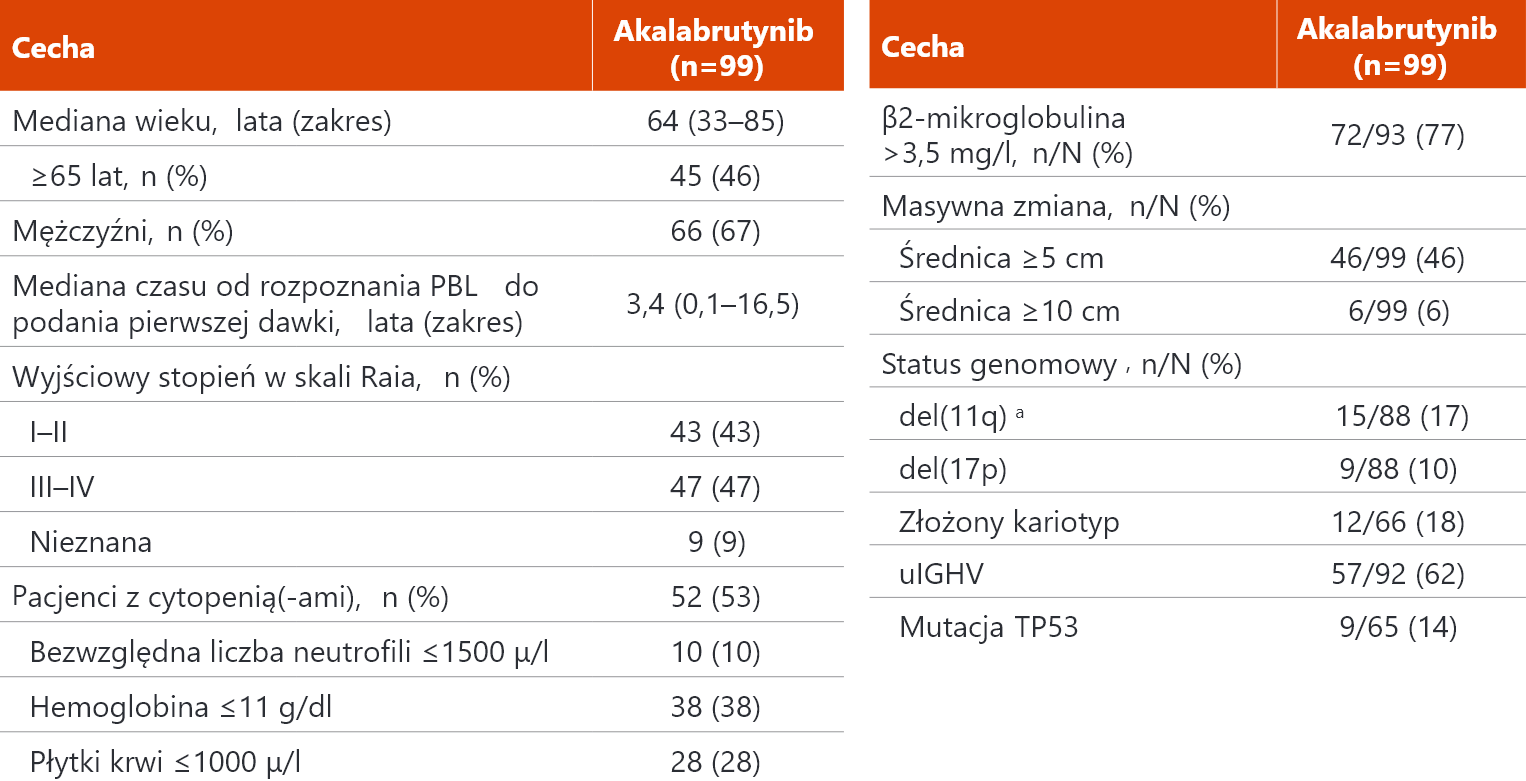
a Pozytywny wynik dla del(11q) bez lub z brakiem del(17p).
PBL – przewlekła białaczka limfatyczna; uIGHV (ang. immunoglobulin heavy chain variable) – niezmutowany region zmienny łańcucha ciężkiego immunoglobulin.
PBL – przewlekła białaczka limfatyczna; uIGHV (ang. immunoglobulin heavy chain variable) – niezmutowany region zmienny łańcucha ciężkiego immunoglobulin.
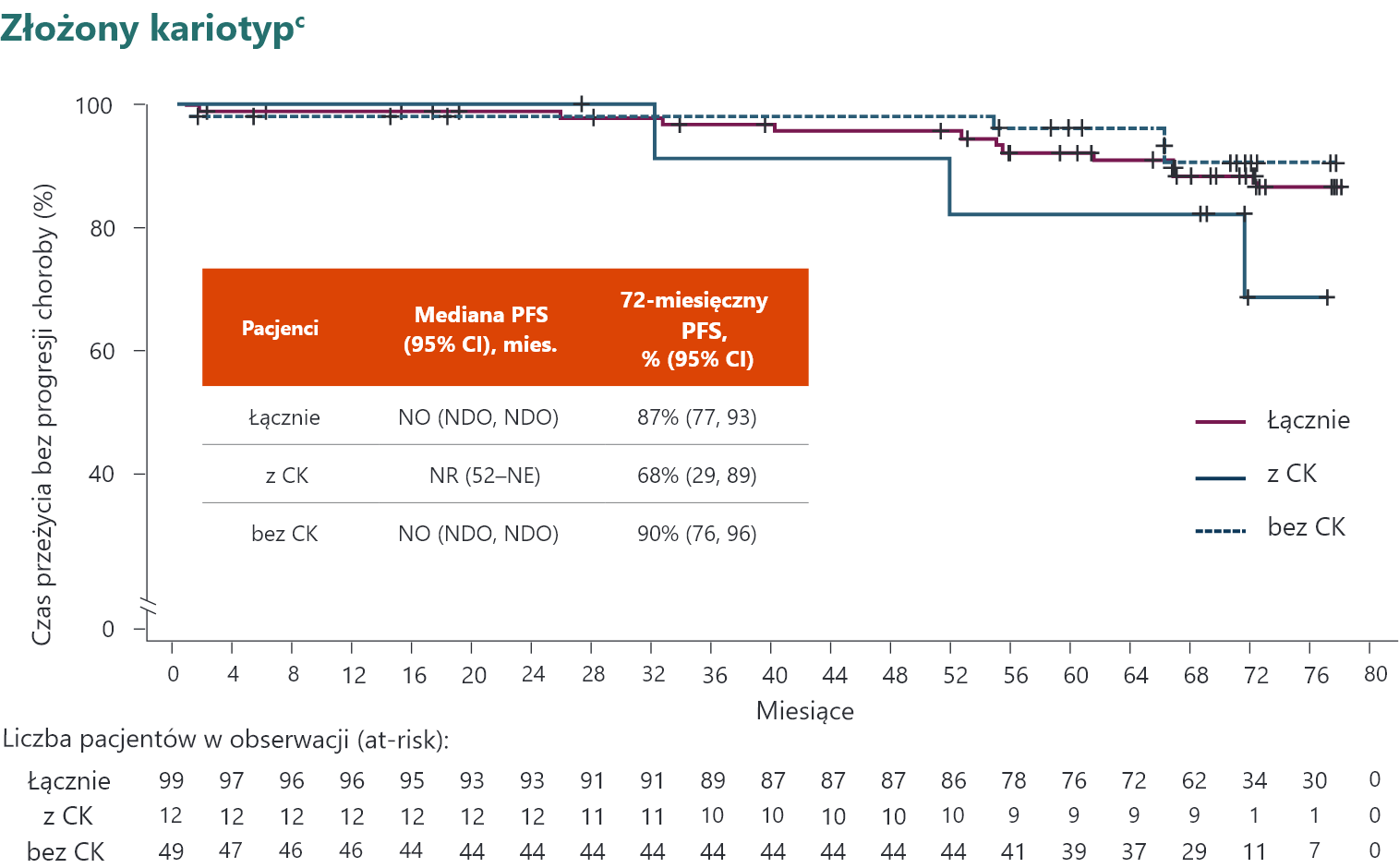
Całkowity PFSa i PFS według cech genomu wysokiego ryzyka3
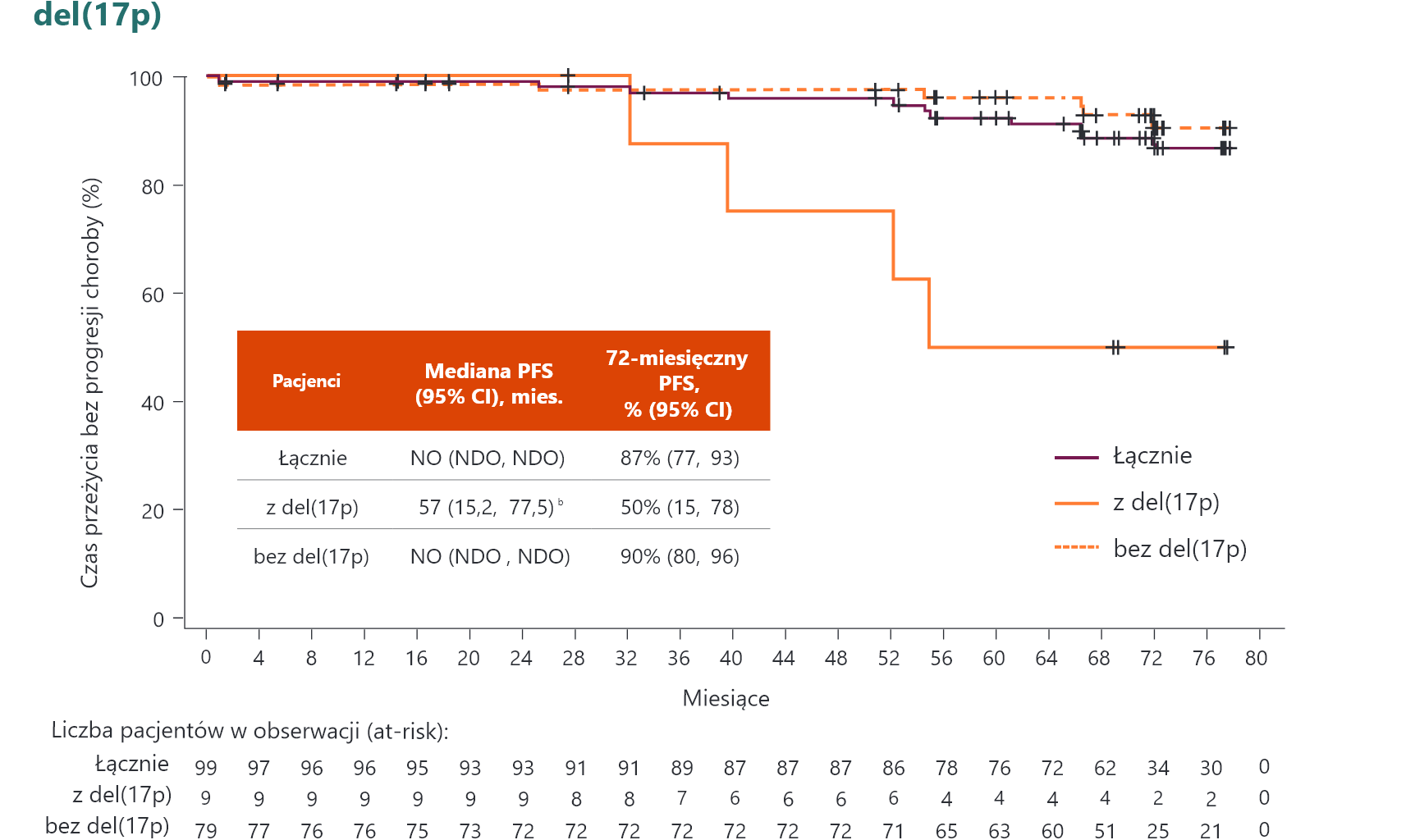
Całkowity PFSa i PFS według cech genomu wysokiego ryzyka3
a PFS zdefiniowano jako czas od daty podania pierwszej dawki do daty pierwszej PD lub zgonu z jakiejkolwiek przyczyny w zależności od tego, co nastąpiło wcześniej.
Pacjenci nie byli objęci obserwacją pod kątem PD, zgonu lub rozpoczęcia nowej terapii po odstawieniu akalabrutynibu. b Duże rozbieżności w szacunkach wynikają z ograniczonej wielkości próby. c Spośród 12 pacjentów z CK (≥3 nieprawidłowości) 5 miało również del(17p). CI (ang. confidence interval) – przedział ufności; CK (ang. complex karyotype) – złożony kariotyp; mies. – miesiące; NDO – niemożliwe do oceny; NE (ang. not estimable) – niemożliwe do oszacowania; NR (ang. not reached) – nie osiągnięto; NO – nie osiągnięto; PFS (ang. progression–free survival) – czas przeżycia bez progresji choroby.
Pacjenci nie byli objęci obserwacją pod kątem PD, zgonu lub rozpoczęcia nowej terapii po odstawieniu akalabrutynibu. b Duże rozbieżności w szacunkach wynikają z ograniczonej wielkości próby. c Spośród 12 pacjentów z CK (≥3 nieprawidłowości) 5 miało również del(17p). CI (ang. confidence interval) – przedział ufności; CK (ang. complex karyotype) – złożony kariotyp; mies. – miesiące; NDO – niemożliwe do oceny; NE (ang. not estimable) – niemożliwe do oszacowania; NR (ang. not reached) – nie osiągnięto; NO – nie osiągnięto; PFS (ang. progression–free survival) – czas przeżycia bez progresji choroby.
Najczęstsze zdarzenia niepożądane związane z leczeniem3
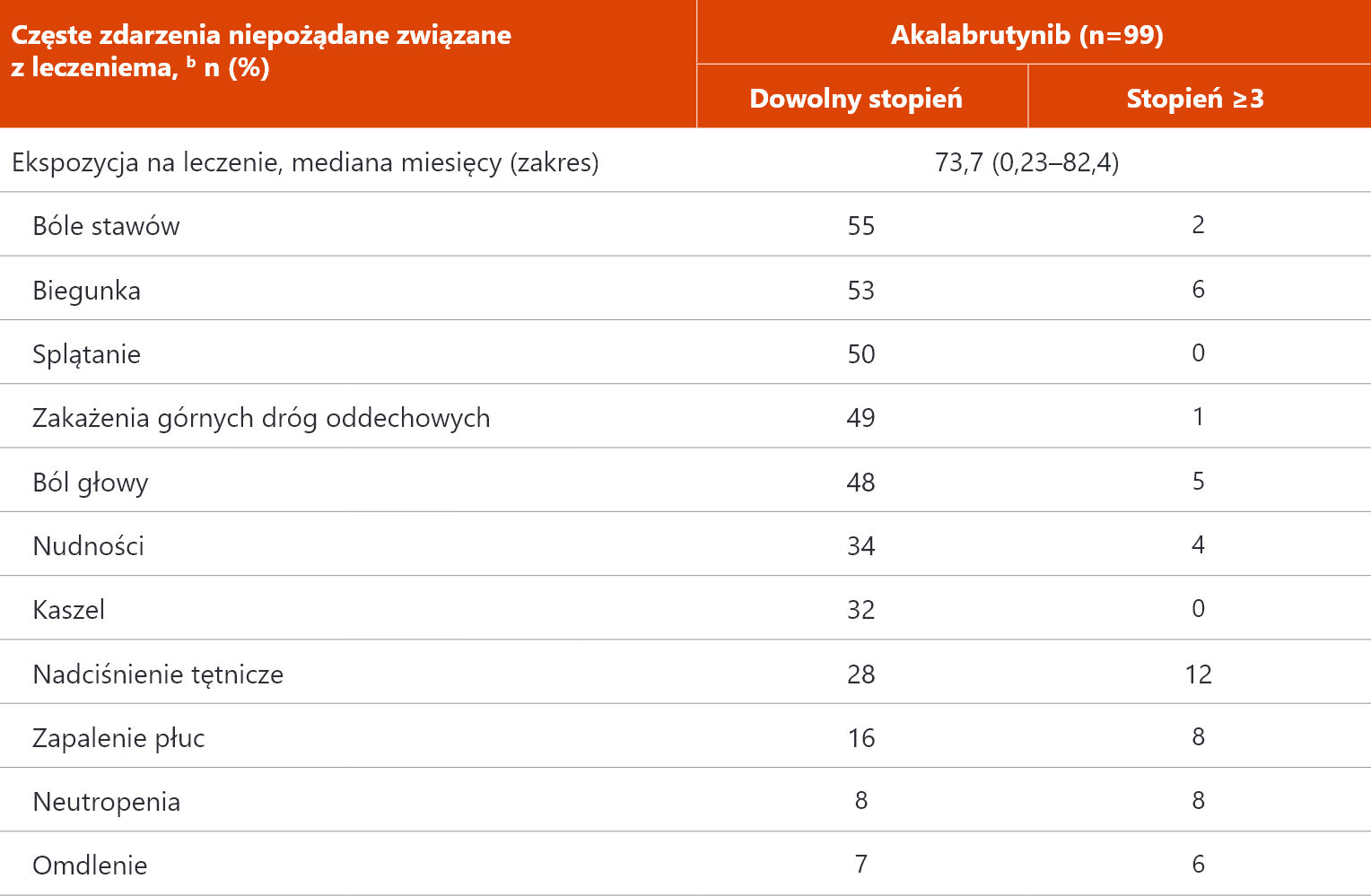
a Obejmuje TEAE dowolnego stopnia u ≥30% pacjentów i TEAE stopnia ≥3 u ≥5% pacjentów. b Wyłączono zdarzenia, dla których preferowane terminy to „wzrost masy ciała” (dowolnego stopnia zgłaszany u 33% pacjentów). TEAEs (ang. treatment emergent adverse events) – zdarzenia niepożądane związane z leczeniem.
Źródła:
1. Sharman J.P. i wsp. Oral Presentation Presented at: ASH; December 9-12, 2023; San Diego.
2. Simon F. et al. Plakat zaprezentowany podczas: 66 dorocznego spotkania Amerykańskiego Towarzystwa Hematologicznego (ASH); grudzień 2024 r.; San Diego, Kalifornia. Plakat nr 4618.
3. Byrd J.C. i wsp. Plakat zaprezentowany podczas: ASH; 10–13 grudnia 2022 r.; Nowy Orlean, Los Angeles.
4. Byrd J.C. i wsp. Blood. 2021; 137 (24): 3327–3338
1. Sharman J.P. i wsp. Oral Presentation Presented at: ASH; December 9-12, 2023; San Diego.
2. Simon F. et al. Plakat zaprezentowany podczas: 66 dorocznego spotkania Amerykańskiego Towarzystwa Hematologicznego (ASH); grudzień 2024 r.; San Diego, Kalifornia. Plakat nr 4618.
3. Byrd J.C. i wsp. Plakat zaprezentowany podczas: ASH; 10–13 grudnia 2022 r.; Nowy Orlean, Los Angeles.
4. Byrd J.C. i wsp. Blood. 2021; 137 (24): 3327–3338
