Informacje o produkcie leczniczym Calquence®

Chłoniak z komórek płaszcza
Dawkowanie i sposób podawania CALQUENCE®
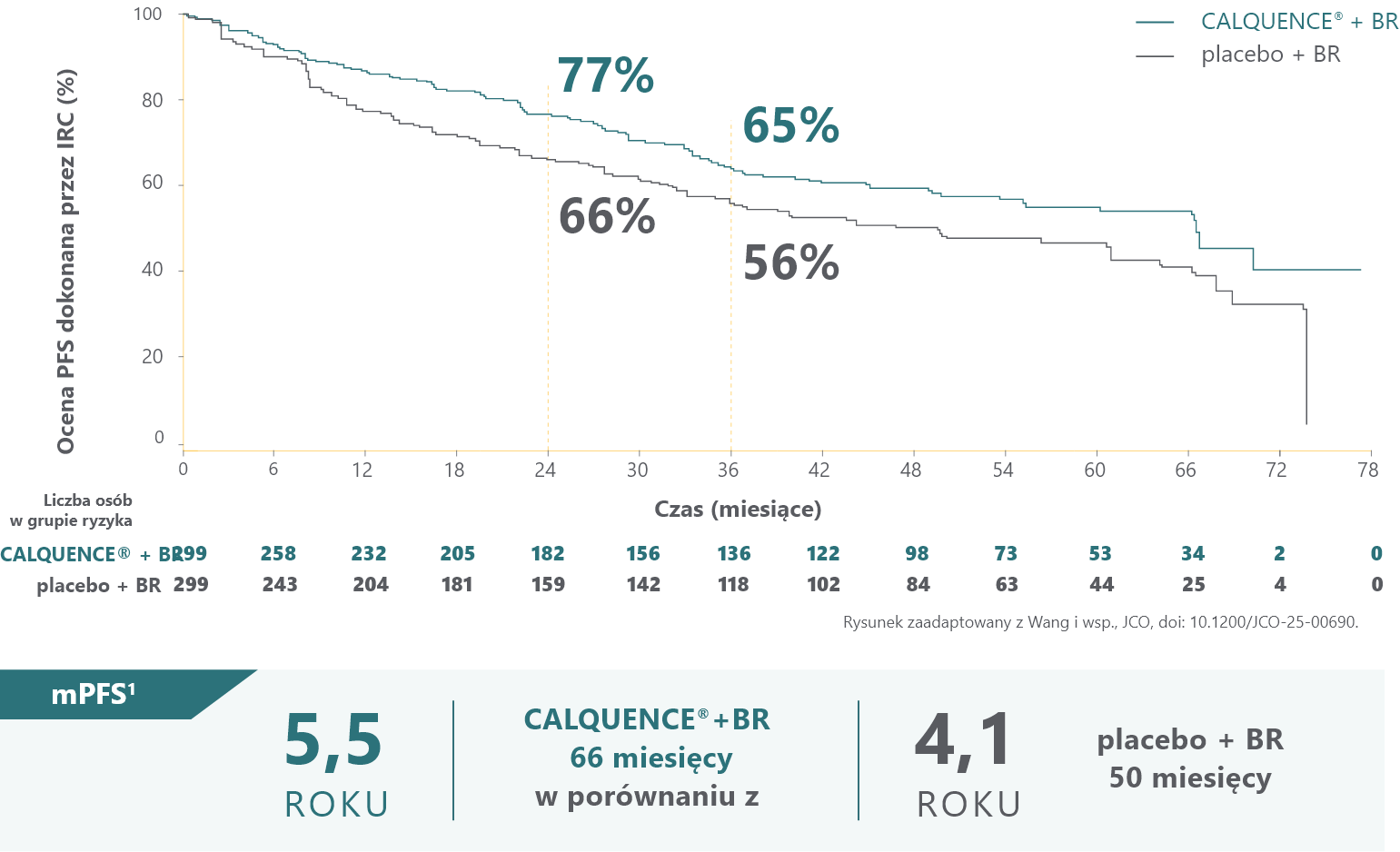
U pacjentów z wcześniej nieleczonym MCL1

CALQUENCE® + BR wykazał statystycznie istotną i klinicznie znaczącą poprawę PFS w porównaniu z placebo + BR przy medianie obserwacji wynoszącej 50 miesięcy (HR = 0,73; 95% CI: 0,57-0,94; p = 0,0160)1,2
-
PFS po 24 i 36 miesiącach na podstawie oszacowania Kaplana-Meiera mają jedynie charakter opisowy. W ECHO nie oceniano statystycznie różnicy między grupami pacjentów w tych punktach czasowych2.
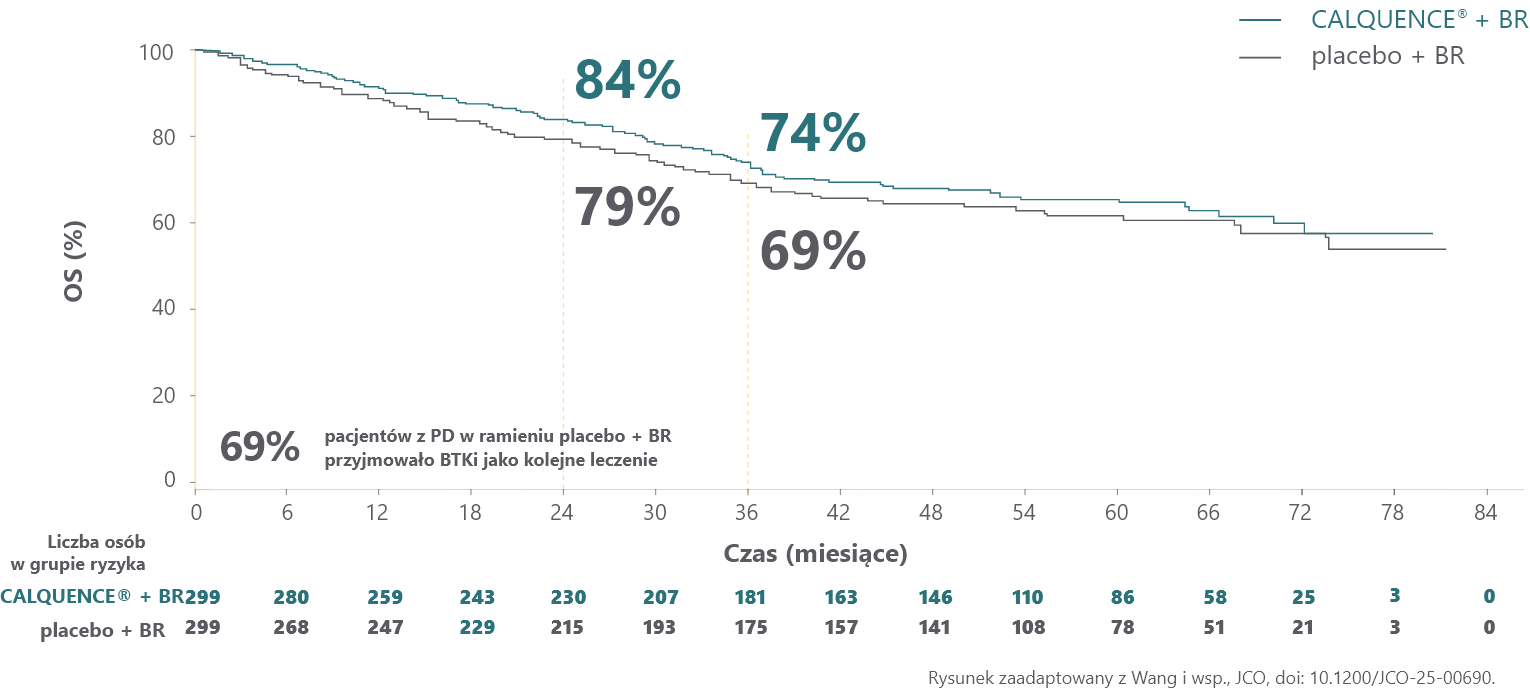
CALQUENCE® + BR wykazał pozytywny trend w kierunku OS w porównaniu z placebo + BR (HR = 0,86; 95% CI: 0,65-1,13; p=0,27; wynik nieistotny statystycznie, nieskorygowany pod kątem wielokrotności analiz*)2,3
Drugorzędowy punkt końcowy2,3
-
Dane dotyczące OS były niedojrzałe (34% dojrzałości danych) w momencie przeprowadzania analizy, dlatego badanie będzie kontynuowane w celu oceny OS jako kluczowego drugorzędowego punktu końcowego2.
-
Odsetki OS po 24 i 36 miesiącach zostały oszacowane na podstawie krzywych Kaplana-Meiera i mają wyłącznie charakter opisowy. Badanie ECHO nie było zaprojektowane do oceny istotności statystycznej różnic pomiędzy grupami leczenia w tych punktach czasowych2.
* Wartości p są opisowe, ponieważ testy hierarchiczne nie osiągnęły poziomu istotności dla wcześniejszego punktu końcowego ORR2.
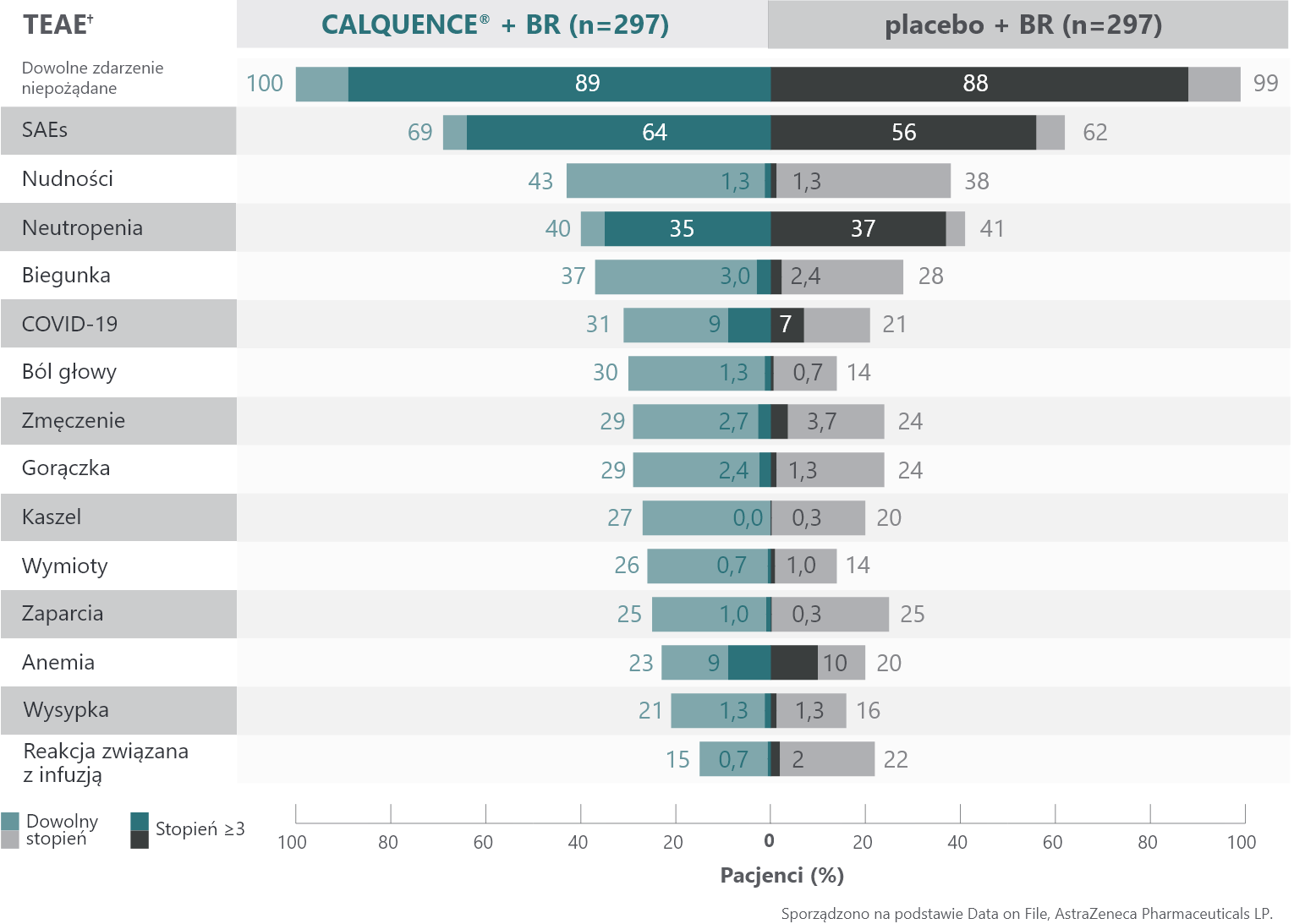
W badaniu ECHO profil bezpieczeństwa CALQUENCE® był zgodny z dotychczas wykazanym profilem2
Większość TEAE było stopnia 1 lub 2 w ramieniu CALQUENCE® + BR2
Częste TEAE (≥20% każdego stopnia)2†
-
Bezpieczeństwo stosowania CALQUENCE® zostało potwierdzone w wielu badaniach III fazy w MCL oraz CLL, obejmujących ponad 85 000 pacjentów leczonych na całym świecie6‡.
-
Nie zidentyfikowano nowych sygnałów bezpieczeństwa podczas stosowania CALQUENCE® w skojarzeniu z BR2.
-
SAE (stopnia ≥3) związane z leczeniem wystąpiły u 64% pacjentów otrzymujących CALQUENCE® + BR i 56% pacjentów przyjmujących placebo + BR2.
-
TEAE stopnia 5 wystąpiły u 12% pacjentów w ramieniu CALQUENCE® + BR oraz u 10% pacjentów w ramieniu placebo + BR (odpowiednio 9% i 7% było związane z COVID-19)2,3.
† TEAE zgłaszano do 30 dni po przyjęciu ostatniej dawki badanego leku. Wg NCI CTCAE wersja 4.032.
‡ Dane na podstawie analizy wewnętrznej AstraZeneca UK Ltd z wykorzystaniem danych z lipca 2024 z różnych źródeł: Dane rzeczywiste IQVIA (amerykańskie dane LRx i Dx na maj 2024 i niemieckie dane LRx na czerwiec 2024) oraz wolumen sprzedaży AstraZeneca CALQUENCE® (ok. 81 000 pacjentów i wszystkie wskazania globalnie) oraz dane z badań klinicznych dotyczących nowotworów hematologicznych. Wskazania mogą się różnić w zależności od kraju6.
‡ Dane na podstawie analizy wewnętrznej AstraZeneca UK Ltd z wykorzystaniem danych z lipca 2024 z różnych źródeł: Dane rzeczywiste IQVIA (amerykańskie dane LRx i Dx na maj 2024 i niemieckie dane LRx na czerwiec 2024) oraz wolumen sprzedaży AstraZeneca CALQUENCE® (ok. 81 000 pacjentów i wszystkie wskazania globalnie) oraz dane z badań klinicznych dotyczących nowotworów hematologicznych. Wskazania mogą się różnić w zależności od kraju6.
Niska częstość występowania zdarzeń sercowo-naczyniowych stopnia ≥3 dla CALQUENCE® + BR3
Częstość występowania migotania przedsionków stopnia ≥3, nadciśnienia i nasilonego krwawienia dla CALQUENCE® + BR była niska3
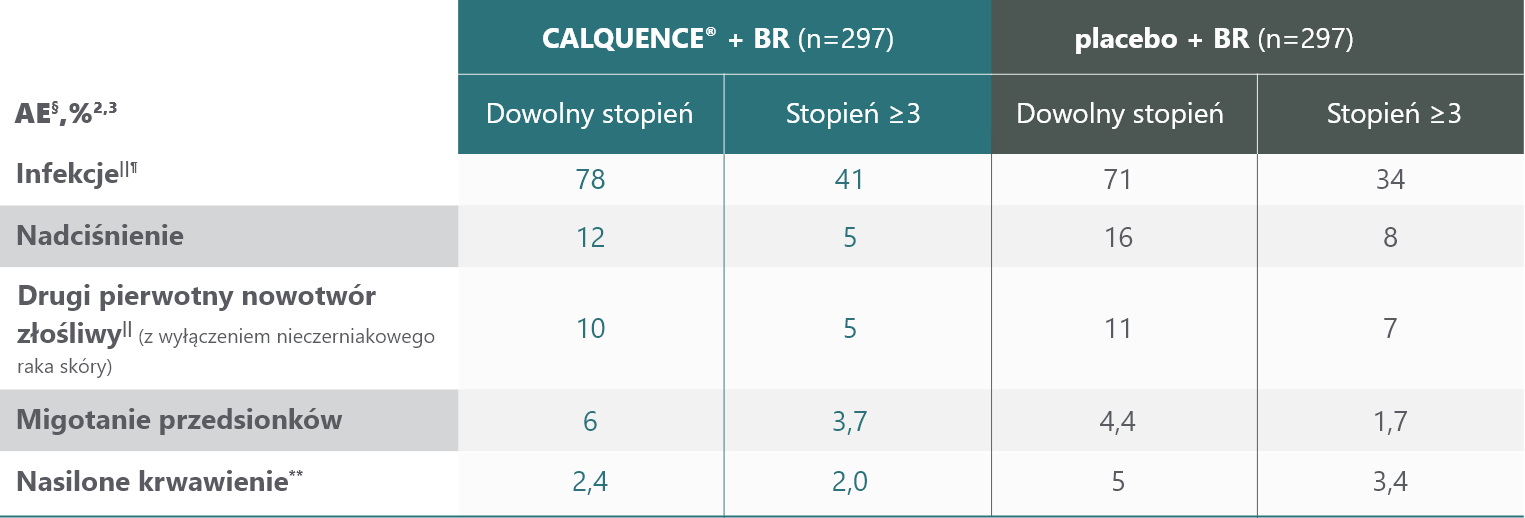
§ AE zgłaszano do 30 dni po przyjęciu ostatniej dawki badanego leku. Wg NCI CTCAE wersja 4.032.
|| Grupowanie preferowanych warunków3.
¶ w tym COVID-192.
** Grupowanie preferowanych warunków zdefiniowane jako zdarzenie krwotoczne poważne lub stopnia nasilenia ≥3 lub krwotok w OUN (dowolny stopień nasilenia)3.
AE = zdarzenie niepożądane; CLL = przewlekła białaczka limfocytowa; OUN = ośrodkowy układ nerwowy; NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Event; SAE = poważne zdarzenie niepożądane; TEAE = zdarzenie niepożądane związane z leczeniem.
|| Grupowanie preferowanych warunków3.
¶ w tym COVID-192.
** Grupowanie preferowanych warunków zdefiniowane jako zdarzenie krwotoczne poważne lub stopnia nasilenia ≥3 lub krwotok w OUN (dowolny stopień nasilenia)3.
AE = zdarzenie niepożądane; CLL = przewlekła białaczka limfocytowa; OUN = ośrodkowy układ nerwowy; NCI CTCAE = National Cancer Institute Common Terminology Criteria for Adverse Event; SAE = poważne zdarzenie niepożądane; TEAE = zdarzenie niepożądane związane z leczeniem.
Modyfikacje dawki w oparciu o zdarzenia niepożądane
Zalecane modyfikacje dawkowania w przypadku zdarzeń niepożądanych u pacjentów przyjmujących CALQUENCE® w skojarzeniu z BR1
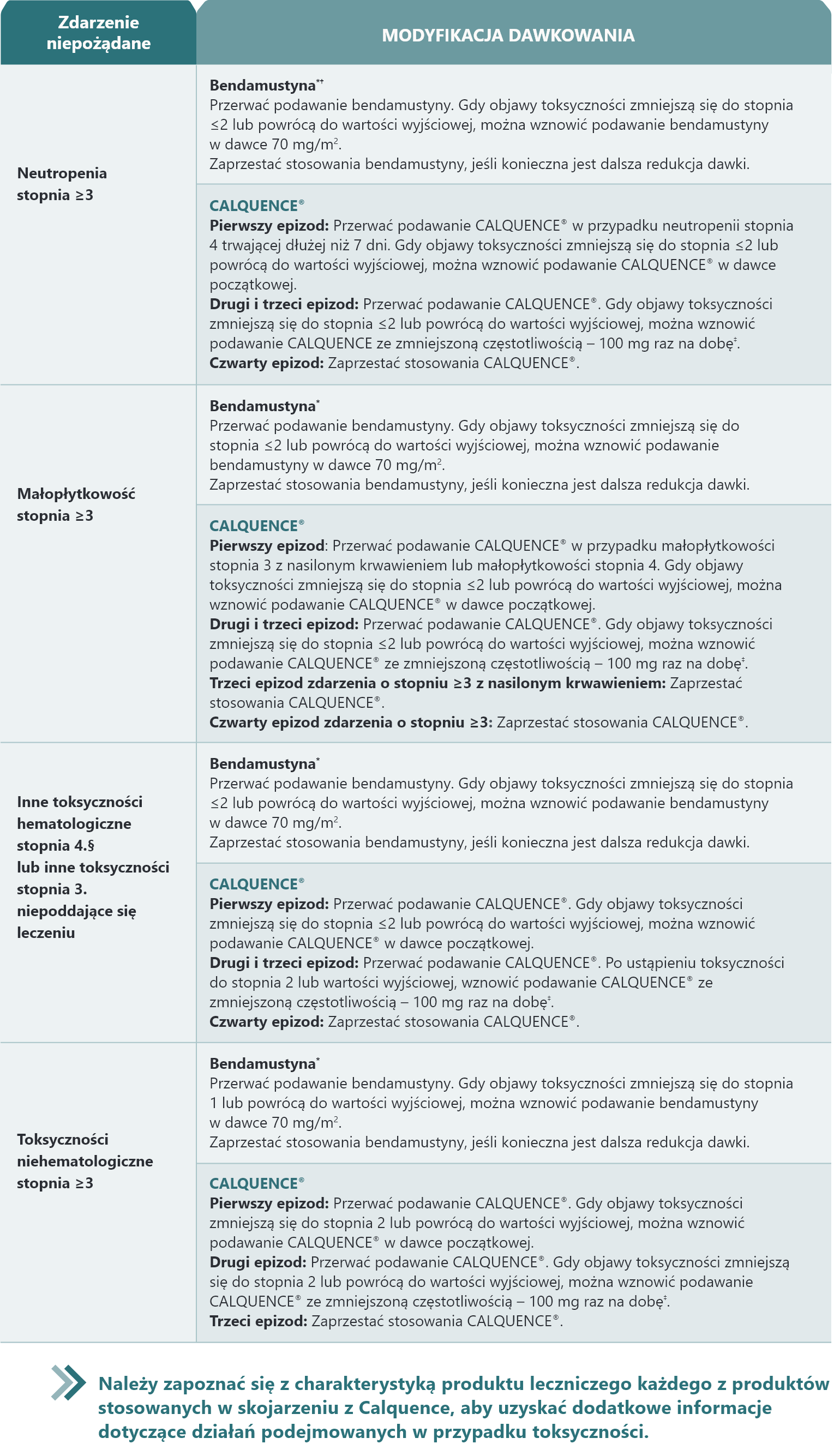
Zdarzenia niepożądane oceniane według skali NCI CTCAE wersja 4.03.
* W przypadku objawów toksyczności niewymienionych w tej tabeli należy zapoznać się z lokalną charakterystyką produktu leczniczego bendamustyny. † Przed modyfikacją dawki bendamustyny należy rozważyć zastosowanie czynników wzrostu szpiku kostnego. ‡ Lekarz może zdecydować o ponownym zwiększeniu dawki, jeśli pacjent toleruje zmniejszoną dawkę przez ≥4 tygodnie. § Limfopenia stopnia 4. jest spodziewanym skutkiem leczenia bendamustyną i rytuksymabem. Modyfikacji dawki z powodu limfopenii należy spodziewać się wyłącznie, jeśli zostanie uznana przez badaczy za klinicznie istotną, np. wiąże się z nawracającymi zakażeniami.
* W przypadku objawów toksyczności niewymienionych w tej tabeli należy zapoznać się z lokalną charakterystyką produktu leczniczego bendamustyny. † Przed modyfikacją dawki bendamustyny należy rozważyć zastosowanie czynników wzrostu szpiku kostnego. ‡ Lekarz może zdecydować o ponownym zwiększeniu dawki, jeśli pacjent toleruje zmniejszoną dawkę przez ≥4 tygodnie. § Limfopenia stopnia 4. jest spodziewanym skutkiem leczenia bendamustyną i rytuksymabem. Modyfikacji dawki z powodu limfopenii należy spodziewać się wyłącznie, jeśli zostanie uznana przez badaczy za klinicznie istotną, np. wiąże się z nawracającymi zakażeniami.
Źródła:
1. Charakterystyka Produktu Leczniczego CALQUENCE, tabletki, lipiec 2025
2. Data on File, REF-264503. AstraZeneca Pharmaceuticals LP.
3. Wang M., Mayer J., Belada D. et al. Acalabrutinib plus bendamustine and rituximab in untreated mantle cell lymphoma (MCL): results from the phase 3, double-blind, placebo-controlled ECHO trial. Abstrakt zaprezentowano podczas dorocznego spotkania Europejskiego Towarzystwa Hematologicznego (EHA) 2024; 13-16 czerwca, Madryt, Hiszpania. Abstract LB3439
1. Charakterystyka Produktu Leczniczego CALQUENCE, tabletki, lipiec 2025
2. Data on File, REF-264503. AstraZeneca Pharmaceuticals LP.
3. Wang M., Mayer J., Belada D. et al. Acalabrutinib plus bendamustine and rituximab in untreated mantle cell lymphoma (MCL): results from the phase 3, double-blind, placebo-controlled ECHO trial. Abstrakt zaprezentowano podczas dorocznego spotkania Europejskiego Towarzystwa Hematologicznego (EHA) 2024; 13-16 czerwca, Madryt, Hiszpania. Abstract LB3439
