Sięgaj dalej

Wieloletnia korzyść kliniczna w 5-letniej obserwacji

Badanie PACIFIC
W badaniu klinicznym PACIFIC podawanie leku IMFINZI® rozpoczęto w ciągu 42 dni od zakończenia jednoczasowej CRT1.

Skuteczność leku IMFINZI® była oceniana u chorych na miejscowo zaawansowanego, nieoperacyjnego NDRP, u których nie nastąpiła progresja po cCRT.1
W badaniu klinicznym PACIFIC chorzy byli losowo przydzielani do grupy otrzymującej lek IMFINZI®, jeżeli zostały spełnione następujące warunki:
- Brak dowodów na progresję choroby. Ośrodki badawcze były zachęcane do wykonania TK/MRI w ciągu 14 dni po CRT,3
- Działania niepożądane CRT Stopnia ≤2‡.Resztkowe działania niepożądane CRT Stopnia ≤ 2 lub zapalenie płuc stopnia ≤1, wywołane przez CRT3§
Analiza czasu przeżycia całkowitego (OS) w zależności od czasu rozpoczęcia podawania leku IMFINZI® (populacja ITT) – analiza pierwotna4


BICR (blinded independent central review) – zaślepiona niezależna ocena centralna; CI (confidence interval) – przedział ufności; cCRT – jednoczasowa radiochemioterapia; CRT – radiochemioterapia; CT – chemioterapia; Gy – gray; HR (hazard ratio) – współczynnik ryzyka; ITT (intent to treat) – zgodnie z intencją leczenia; MRI – rezonans magnetyczny; NDRP – niedrobnokomórkowy rak płuca; OS (overall survival) – czas przeżycia całkowitego; PFS (progression-free survival) – czas wolny od progresji choroby; RECIST (Response Evaluation Criteria In Solid Tumors) – kryteria oceny odpowiedzi na leczenie w guzach litych; RT – radioterapia; TK – tomografia komputerowa; WHO (World Health Organization) – Światowa Organizacja Zdrowia.
Schemat badania: Badanie kliniczne PACIFIC było międzynarodowym, wieloośrodkowym randomizowanym badaniem fazy III, prowadzonym metodą podwójnie ślepej próby, kontrolowanym placebo z udziałem 713 chorych na miejscowo zaawansowanego, nieoperacyjnego NDRP, u których nie nastąpiła progresja po jednoczasowej CRT opartej na pochodnych platyny. Chorzy ukończyli przynajmniej 2 cykle radykalnej chemioterapii opartej na pochodnych platyny z radioterapią w ciągu od 1 do 42 dni przed rozpoczęciem badania i których stan sprawności w skali ECOG wynosił 0 lub 1. 92% chorych otrzymało całkowitą dawkę napromieniania od 54 do 66 Gy. Chorych przydzielono do grup w sposób losowy w proporcji 2:1; przyjmowali oni 10 mg/kg mc. leku IMFINZI® (n=476) lub 10 mg/kg mc. placebo (n=237) w infuzji dożylnej co 2 tygodnie przez okres do 12 miesięcy lub do czasu wystąpienia nieakceptowalnej toksyczności bądź potwierdzonej progresji choroby. Randomizację stratyfikowano według płci, wieku (< 65 lat lub ≥ 65 lat) oraz statusu palenia tytoniu (pacjent palący lub pacjent niepalący). Chorzy byli włączani do badania niezależnie od stwierdzanego u nich poziomu ekspresji PD-L1. Równorzędnymi pierwszorzędowymi punktami końcowymi były PFS (mierzone na podstawie kryteriów RECIST v1.1 przez BICR) i OS.1,3
*U chorych na miejscowo zaawansowanego, nieoperacyjnego NDRP, u których nie nastąpiła progresja choroby po cCRT opartej na pochodnych platyny.1
†Informacje na temat modyfikacji leczenia znajdują się w Informacji o Leku IMFINZI®.
†Z wyjątkiem zapalenia płuc o podłożu immunologicznym.3
§Początkowo z badania wykluczono chorych z zapaleniem płuc Stopnia 1, wywołanym przez CRT.3
Mechanizm działania
Aktywacja odpowiedzi immunologicznej – przesłanki za stosowaniem leku IMFINZI® (durwalumab) po radiochemioterapii5-10
W modelach przedklinicznych zaobserwowano zwiększenie ekspresji PD-L1 na powierzchni komórek nowotworowych po radiochemioterapii.5-7
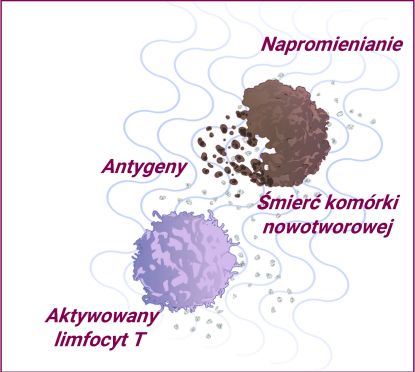
Radiochemioterapia powoduje śmierć komórek nowotworowych, co prowadzi do uwalniania wielu antygenów i przekształcania guzów „zimnych” w guzy „gorące”.11,12
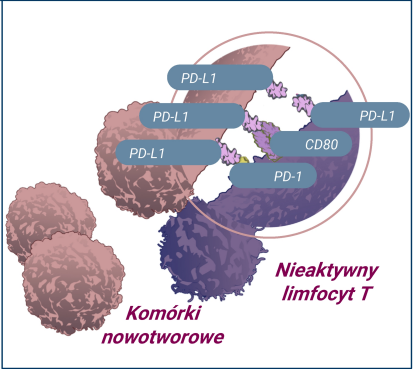
Interakcja pomiędzy receptorami PD-1, CD80 a PD-L1 hamuje odpowiedź immunologiczną, co ułatwia ponowny rozrost nowotworu.6-8,13
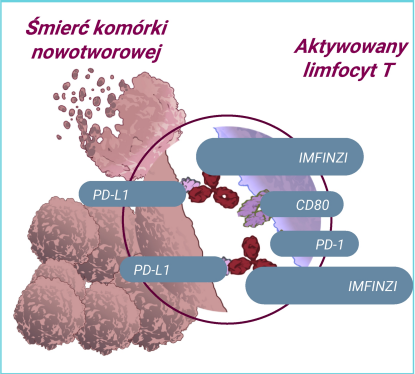
Durwalumab wiąże się z PD-L1, uniemożliwiając oddziaływanie PD-L1 z jego receptorami, co prowadzi do przywrócenia aktywacji limfocytów T i nasilenia odpowiedzi immunologicznej, w tym skierowanej przeciwko komórkom nowotworowym.8,12,14
CD80 (cluster of differentiation 80) – kompleks (antygen) różnicowania komórkowego 80; PD-1 (programmed cell death-1) – receptor programowanej śmierci komórki 1; PD-L1 (programmed cell death ligand-1) – ligand receptora programowanej śmierci komórki 1.
Referencje:
- Charakterystyka Produktu Leczniczego IMFINZI, zatwierdzona dn. 24 kwietnia 2023 roku.
- Rodrigues G. i wsp. Pract Radiat Oncol. 2015; 5 (3): 141-148.
- Antonia S.J. i wsp. N Engl J Med. 2017; 377 (20): 1919-1929.
- Antonia S.J. i wsp. N Engl J Med. 2018; 379 (24): 2342-2350.
- Reits E.A. i wsp. J Exp Med. 2006; 203 (5): 1259-1271.
- Dovedi S.J. i wsp. Cancer Res. 2014; 74 (19): 5458-5468.
- Deng L. i wsp. J Clin Invest. 2014; 124 (2): 687-695.
- Stewart R. i wsp. Cancer Immunol Res. 2015; 3 (9): 1052-1062.
- Hato S.V. i wsp. Clin Cancer Res. 2014; 20 (11): 2831-2837.
- Ibrahim R. i wsp. Semin Oncol. 2015; 42 (3): 474-483.
- Portella L., Scala S. Semin Oncol. 2019; 46 (3): 254-260.
- Galon J., Bruni D. Nat Rev Drug Discov. 2019; 18 (3): 197-218.
- Haile S.T. i wsp. J Immunol. 2013; 191 (5): 2829-2836.
- Qian J.M. i wsp. Cancer. 2016; 122 (19): 3051-3058.
WAŻNE INFORMACJE DOTYCZĄCE BEZPIECZEŃSTWA
DZIAŁANIA NIEPOŻĄDANE O PODŁOŻU IMMUNOLOGICZNYM
Ze stosowaniem leku IMFINZI® związane jest występowanie działań niepożądanych na podłożu immunologicznym. Większość z nich, w tym reakcje ciężkie, ustępowały po wdrożeniu odpowiedniego leczenia farmakologicznego i(lub) po modyfikacji leczenia.
Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów działań niepożądanych o podłożu immunologicznym W przypadku podejrzewania wystąpienia działań niepożądanych o podłożu immunologicznym należy przeprowadzić odpowiednią ocenę w celu potwierdzenia przyczyny lub wykluczenia innej możliwej etiologii.
W zależności od stopnia nasilenia działania niepożądanego należy wstrzymać podawanie leku IMFINZI® i (lub) tremelimumab i podać kortykosteroidy. Należy rozważyć zwiększenie dawki kortykosteroidów i (lub) zastosowanie dodatkowych leków immunosupresyjnych o działaniu ogólnoustrojowym, jeżeli występuje pogorszenie lub brak poprawy. Po uzyskaniu zmniejszenia nasilenia do stopnia ≤ 1. należy rozpocząć i kontynuować zmniejszanie dawki kortykosteroidów przez przynajmniej 1 miesiąc. Po wstrzymaniu podawania można wznowić leczenie lekiem IMFINZI® i (lub) tremelimumabem w czasie do 12 tygodni, jeżeli nasilenie działań niepożądanych ulegnie zmniejszeniu do stopnia ≤ 1. a dawkę kortykosteroidów zredukowano do ≤ 10 mg prednizonu lub jego odpowiednika na dobę. Stosowanie leku IMFINZI® i (lub) tremelimumabu należy całkowicie zakończyć w przypadku nawracających działań niepożądanych o podłożu immunologicznym Stopnia 3. (ciężkie) i dowolnych działań niepożądanych o podłożu immunologicznym Stopnia 4. (zagrażające życiu), z wyjątkiem endokrynopatii kontrolowanych za pomocą hormonalnej terapii zastępczej.
Zapalenie płuc o podłożu immunologicznym
U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowało zapalenie płuc o podłożu immunologicznym lub choroba śródmiąższowa płuc, zdefiniowane jako wymagające podania kortykosteroidów o działaniu ogólnoustrojowym i bez wyodrębnionej innej przyczyny (patrz punkt 4.8 ChPL).
Zapalenie płuc i popromienne zapalenie płuc
Popromienne zapalenie płuc jest często obserwowane u pacjentów poddawanych radioterapii na obszar płuc, a objawy kliniczne zapalenia płuc i popromiennego zapalenia płuc są bardzo podobne.
W badaniu klinicznym PACIFIC z udziałem pacjentów, którzy zakończyli jednoczasową chemioradioterapię z podaniem co najmniej 2 cykli chemioterapii, w czasie od 1 do 42 dni przed rozpoczęciem badania klinicznego, zapalenie płuc lub popromienne zapalenie płuc wystąpiło u 161 (33,9%) pacjentów w grupie leczonej lekiem IMFINZI® i 58 (24,8%) pacjentów w grupie otrzymującej placebo, w tym w 3. stopniu nasilenia (3,4% w porównaniu z 3,0%) i 5. stopniu nasilenia (1,1% w porównaniu z 1,7%). Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów zapalenia płuc lub popromiennego zapalenia płuc. Podejrzewane zapalenie płuc należy potwierdzić w ocenie radiologicznej oraz należy wykluczyć inne przyczyny związane z zakażeniami i stanami chorobowymi i stosować leczenie zgodne z zaleceniami zawartymi w punkcie 4.2. ChPL.
Zapalenie wątroby o podłożu immunologicznym
U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowało zapalenie wątroby o podłożu immunologicznym, zdefiniowane jako wymagające podania kortykosteroidów o działaniu ogólnoustrojowym i bez wyodrębnionej innej przyczyny (patrz punkt 4.8 ChPL). Należy monitorować aktywność transaminazy alaninowej, transaminazy asparaginianowej, stężenie bilirubiny całkowitej i aktywność fosfatazy alkalicznej przed rozpoczęciem leczenia i przed każdym kolejnym wlewem. Należy rozważyć dodatkowe monitorowanie na podstawie oceny klinicznej. Zapalenie wątroby o podłożu immunologicznym powinno być leczone zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Zapalenie jelita grubego o podłożu immunologicznym
U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowało zapalenie jelita grubego lub biegunka o podłożu immunologicznym, zdefiniowane jako wymagające podania kortykosteroidów o działaniu ogólnoustrojowym i bez wyodrębnionej innej przyczyny (patrz punkt 4.8 ChPL). U pacjentów przyjmujących produkt leczniczy IMFINZI w skojarzeniu z tremelimumabem zgłaszano działania niepożądane leku w postaci perforacji jelit i perforacji jelita grubego. Pacjentów należy monitorować pod kątem wystąpienia objawów podmiotowych i przedmiotowych zapalenia jelita grubego/biegunki i perforacji jelita oraz leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Endokrynopatie o podłożu immunologicznym
Niedoczynność tarczycy, nadczynność tarczycy i zapalenie tarczycy o podłożu immunologicznym: U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowały przypadki niedoczynności tarczycy, nadczynności tarczycy i zapalenia tarczycy o podłożu immunologicznym; niedoczynność tarczycy może wystąpić po nadczynności tarczycy (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem nieprawidłowych wyników badań czynności tarczycy przed i okresowo podczas leczenia oraz zgodnie ze wskazaniami opartymi na ocenie klinicznej. Niedoczynność tarczycy, nadczynność tarczycy i zapalenie tarczycy o podłożu immunologicznym należy leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Niewydolność kory nadnerczy o podłożu immunologicznym: U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowały przypadki niewydolności kory nadnerczy o podłożu immunologicznym (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów niewydolności kory nadnerczy. W przypadku objawowej niewydolności kory nadnerczy, pacjentów należy leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Cukrzyca typu 1 o podłożu immunologicznym: U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowały przypadki cukrzycy typu 1 o podłożu immunologicznym, która może początkowo objawiać się w postaci kwasicy ketonowej, której późne wykrycie może prowadzić do zgonu (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów cukrzycy typu 1. W przypadku objawowej cukrzycy typu 1, pacjentów należy leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Zapalenie przysadki/niedoczynność przysadki o podłożu immunologicznym: U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowało zapalenie przysadki lub niedoczynność przysadki o podłożu immunologicznym (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów zapalenia przysadki lub niedoczynności przysadki. W przypadku objawowego zapalenia przysadki lub niedoczynności przysadki, pacjentów należy leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Zapalenie nerek o podłożu immunologicznym
U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowało zapalenie nerek o podłożu immunologicznym, zdefiniowane jako wymagające podania kortykosteroidów o działaniu ogólnoustrojowym i bez wyodrębnionej innej przyczyny (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem nieprawidłowych wyników badań czynności nerek przed i okresowo podczas leczenia lekiem IMFINZI® lub lekiem IMFINZI® w skojarzeniu z tremelimumabem oraz leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Wysypka o podłożu immunologicznym
U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowały przypadki wysypki i zapalenia skóry (w tym pemfigoid) o podłożu immunologicznym, zdefiniowane jako wymagające podania kortykosteroidów o działaniu ogólnoustrojowym i bez wyodrębnionej innej przyczyny (patrz punkt 4.8 ChPL). U pacjentów leczonych inhibitorami PD-1 zgłaszano występowanie incydentów zespołu Stevens-Johnsona lub toksycznej martwicy rozpływnej naskórka. Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów wysypki lub zapalenia skóry oraz leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Zapalenie mięśnia sercowego o podłożu immunologicznym
U pacjentów przyjmujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem występowały przypadki zapalenia mięśnia sercowego o podłożu immunologicznym, które może być śmiertelne (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów zapalenia mięśnia sercowego o podłożu immunologicznym oraz leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2 ChPL.
Zapalenie trzustki o podłożu immunologicznym
U pacjentów przyjmujących lek IMFINZI® w skojarzeniu z tremelimumabem i chemioterapią występowały przypadki zapalenia trzustki o podłożu immunologicznym (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów zapalenia trzustki o podłożu immunologicznym oraz leczyć zgodnie z zaleceniami zawartymi w punkcie 4.2.
Inne działania niepożądane o podłożu immunologicznym
Uwzględniając mechanizm działania leku IMFINZI® lub leku IMFINZI® w skojarzeniu z tremelimumabem, mogą wystąpić inne działania niepożądane o podłożu immunologicznym. U pacjentów leczonych lekiem IMFINZI® w monoterapii lub w skojarzeniu z tremelimumabem obserwowano następujące działania niepożądane o podłożu immunologicznym: miastenia, poprzeczne zapalenie rdzenia kręgowego, zapalenie mięśni, zapalenie wielomięśniowe, zapalenie opon mózgowo-rdzeniowych, zapalenie mózgu, zespół Guillaina-Barrégo, trombocytopenia o podłożu immunologicznym i niezakaźne zapalenie pęcherza moczowego (patrz punkt 4.8 ChPL). Pacjentów należy monitorować pod kątem objawów przedmiotowych i podmiotowych oraz postępować zgodnie z zaleceniami podanymi w punkcie 4.2 ChPL.
Reakcje związane z infuzją
Pacjentów należy monitorować pod kątem podmiotowych i przedmiotowych objawów reakcji związanych z infuzją. Zgłaszano przypadki ciężkich reakcji związanych z infuzją u pacjentów otrzymujących lek IMFINZI® lub lek IMFINZI® w skojarzeniu z tremelimumabem (patrz punkt 4.8 ChPL). W przypadku reakcji związanych z infuzją należy postępować zgodnie z zaleceniami podanymi w punkcie 4.2 ChPL.
Środki ostrożności związane z leczoną chorobą (RDŻ, rak dróg żółciowych)
Zapalenie i zakażenie dróg żółciowych
Zapalenie oraz zakażenia dróg żółciowych nie są rzadką diagnozą u pacjentów z zaawansowanym RDŻ. Zapalenie dróg żółciowych zgłaszano w badaniu TOPAZ-1 w obu grupach terapeutycznych (14,5% [IMFINZI® + chemioterapia] w porównaniu z 8,2% [placebo + chemioterapia]; były one przeważnie związane z obecnością stentów w przewodach żółciowych, a ich etiologia nie miała podłoża immunologicznego. Pacjenci z RDŻ (zwłaszcza pacjenci ze stentami w przewodach żółciowych) powinni być ściśle monitorowani pod kątem występowania zapalenia lub zakażeń dróg żółciowych przed rozpoczęciem leczenia, a następnie w regularnych odstępach czasu.
NDRP w stadium rozsiewu
Dostępne są ograniczone dane dotyczące pacjentów w podeszłym wieku (≥ 75 lat) leczonych lekiem IMFINZI® w skojarzeniu z tremelimumabem i chemioterapią opartą na pochodnych platyny (patrz punkt 4.8 i 5.1 ChPL). Zaleca się staranne rozważenie stosunku potencjalnych korzyści do ryzyka w związku ze stosowaniem tego schematu leczenia w indywidualnych przypadkach.
WPŁYW NA PŁODNOŚĆ, CIĄŻĘ I LAKTACJĘ
Kobiety w wieku rozrodczym
Kobiety w wieku rozrodczym powinny stosować skuteczne środki zapobiegania ciąży w trakcie leczenia durwalumabem i przez co najmniej 3 miesiące po przyjęciu ostatniej dawki durwalumabu.
Ciąża
Brak danych dotyczących stosowania durwalumabu u kobiet w okresie ciąży. W oparciu o mechanizm działania durwalumab ma potencjał wpływania na utrzymanie ciąży, a w mysim modelu allogenicznej ciąży wykazano, że zaburzenie szlaku sygnałowego PD-L1 skutkuje zwiększoną częstością poronień. Badania durwalumabu na zwierzętach nie wskazują na szkodliwy wpływ na reprodukcję (patrz punkt 5.3 ChPL). Wiadomo, że ludzka IgG1 przenika przez barierę łożyskową, a przenikanie durwalumabu przez łożysko zostało potwierdzone w badaniach na zwierzętach. Podawanie durwalumabu kobietom w okresie ciąży może mieć szkodliwy wpływ na płód i nie zaleca się stosowania durwalumabu w okresie ciąży oraz u kobiet w wieku rozrodczym, które nie stosują skutecznych środków zapobiegania ciąży podczas leczenia i przez co najmniej 3 miesiące po przyjęciu ostatniej dawki.
Karmienie piersią
Nie wiadomo, czy durwalumab przenika do mleka ludzkiego. Na podstawie dostępnych danych toksykologicznych dotyczących małp cynomolgus stwierdzono niskie stężenie durwalumabu w mleku w 28. dniu po porodzie (patrz punkt 5.3 ChPL). U ludzi przeciwciała mogą przeniknąć do mleka, ale potencjał wchłaniania i wywierania szkodliwego wpływu na noworodki jest nieznany. Jednakże nie można wykluczyć potencjalnego ryzyka dla dziecka karmionego piersią. Należy podjąć decyzję, czy kobieta powinna zaprzestać karmienia piersią lub zaprzestać albo nie rozpoczynać leczenia durwalumabem, uwzględniając korzyści wynikające z karmienia piersią dla dziecka oraz korzyści wynikające z leczenia dla pacjentki.
Płodność
Brak danych dotyczących potencjalnego wpływu durwalumabu na płodność ludzi lub zwierząt.
Działania niepożądane
Nasilenie działań niepożądanych oceniano według CTCAE, definiując stopień 1. jako łagodny, stopień 2. jako umiarkowany, stopień 3. jako ciężki, stopień 4. jako zagrażający życiu i stopień 5. jako zgon.Nie określono bezpieczeństwa stosowania ani skuteczności leku IMFINZI u dzieci i młodzieży w wieku poniżej 18. roku życia. Dane nie są dostępne.
IMFINZI® w monoterapii
Bezpieczeństwo leku IMFINZI® stosowanego w monoterapii opiera się na danych zbiorczych pochodzących od 3006 pacjentów z licznymi rodzajami guzów. Lek IMFINZI® podawano w dawce 10 mg/kg mc. co 2 tygodnie lub 20 mg/kg mc. co 4 tygodnie. Najczęstszymi (>10%) działaniami niepożądanymi były: kaszel/mokry kaszel (21,5%), biegunka (16,3%), wysypka (16,0%), gorączka (13,8%), zakażenia górnych dróg oddechowych (13,5%), ból brzucha (12,7%), świąd (10,8%) oraz niedoczynność tarczycy (10,1%). Najczęstszymi (>2%) działaniami niepożądanymi stopnia ≥ 3. było zapalenie płuc (3,5%) i zwiększenie aktywności transaminazy asparaginianowej/zwiększenie aktywności transaminazy alaninowej (2,3%). Stosowanie leku IMFINZI® zostało zakończone z powodu działań niepożądanych u 3,6% pacjentów. Najczęstszym działaniem niepożądanym prowadzącym do zakończenia leczenia było zapalenie pęcherzyków płucnych (1,1%) i zapalenie płuc (0,8%). Stosowanie leku IMFINZI® zostało opóźnione lub przerwane z powodu działań niepożądanych u 13,7% pacjentów. Najczęstszymi działaniami niepożądanymi prowadzącymi do opóźnienia lub przerwania leczenia były: zapalenie płuc (2,7%) i zwiększenie aktywności transaminazy asparaginianowej/zwiększenie aktywności transaminazy alaninowej (1,7%).
IMFINZI® w skojarzeniu z chemioterapią
Bezpieczeństwo stosowania leku IMFINZI® podawanego w skojarzeniu z chemioterapią opiera się na danych zbiorczych pochodzących od 603 pacjentów uczestniczących w 2 badaniach (TOPAZ-1 i CASPIAN). Najczęstszymi (>10%) działaniami niepożądanymi były: neutropenia (53,1%), niedokrwistość (43,9%), nudności (37,5%), uczucie zmęczenia (36,8%), małopłytkowość (28,0%), zaparcia (25,4%), zmniejszone łaknienie (22,6%), ból brzucha (18,4%), łysienie (18,4%), leukopenia (17,2%), wymioty (16,9%), gorączka (15,1%), wysypka (14,8%), biegunka (13,8%), zwiększenie aktywności transaminazy asparaginianowej lub transaminazy alaninowej (10,9%), kaszel/kaszel mokry (10,8%) i świąd (10,4%). Najczęstszymi (>2%) działaniami niepożądanymi stopnia ≥ 3. były: neutropenia (35,2%), niedokrwistość (17,4%), małopłytkowość (11,1%), leukopenia (7,1%), uczucie zmęczenia (5,0%), gorączka neutropeniczna (3,0%), zwiększenie aktywności transaminazy asparaginianowej lub zwiększenie aktywności transaminazy alaninowej (2,8%) i zapalenie płuc (2,5%). Stosowanie leku IMFINZI® zostało zakończone z powodu działań niepożądanych u 2,0% pacjentów. Najczęstszym działaniem niepożądanym prowadzącym do zakończenia leczenia było uczucie zmęczenia (0,3%). Stosowanie leku IMFINZI® zostało opóźnione lub przerwane z powodu działań niepożądanych u 29,2% pacjentów. Najczęstszymi działaniami niepożądanymi prowadzącymi do opóźnienia lub przerwania leczenia były: neutropenia (17,1%), niedokrwistość (3,8%), małopłytkowość (4,3%), leukopenia (3,5%), uczucie zmęczenia (1,7%) i gorączka (1,3%).
IMFINZI® w skojarzeniu z tremelimumabem w dawce 75 mg i chemioterapią opartą na pochodnych platyny
Bezpieczeństwo stosowania leku IMFINZI® podawanego w skojarzeniu z tremelimumabem 75 mg i chemioterapią opiera się na danych pochodzących od 330 pacjentów z NDRP w stadium rozsiewu. Najczęstszymi (>20%) działaniami niepożądanymi były: niedokrwistość (49,7%), nudności (41,5%), neutropenia (41,2%), uczucie zmęczenia (36,1%), wysypka (25,8%), małopłytkowość (24,5%) i biegunka (21,5%). Najczęstszymi (>2%) działaniami niepożądanymi stopnia ≥ 3. były: neutropenia (23,9%), niedokrwistość (20,6%), zapalenie płuc (9,4%), małopłytkowość (8,2%), leukopenia (5,5%), uczucie zmęczenia (5,2%), zwiększenie aktywności lipazy (3,9%), zwiększenie aktywności amylazy (3,6%), gorączka neutropeniczna (2,4%), zapalenie jelita grubego (2,1%) oraz zwiększenie aktywności transaminazy asparaginianowej/zwiększenie aktywności transaminazy alaninowej (2,1%). Leczenie lekiem IMFINZI® zakończono z powodu działań niepożądanych u 8,5% pacjentów. Najczęstszymi działaniami niepożądanymi prowadzącymi do zakończenia leczenia były: zapalenie płuc (2,1%) i zapalenie jelita grubego (1,2%). Leczenie lekiem IMFINZI® zostało przerwane z powodu działań niepożądanych u 49,4% pacjentów. Najczęstszymi działaniami niepożądanymi prowadzącymi do przerwania leczenia były: neutropenia (16,1%), niedokrwistość (10,3%), małopłytkowość (7,3%), leukopenia (5,8%), zapalenie płuc (5,2%), zwiększenie aktywności transaminazy asparaginianowej/zwiększenie aktywności transaminazy alaninowej (4,8%), zapalenie jelita grubego (3,3%) i zapalenie pęcherzyków płucnych (3,3%).
IMFINZI® w skojarzeniu z tremelimumabem 300 mg
Ocena bezpieczeństwa stosowania leku IMFINZI® podawanego w skojarzeniu z pojedynczą dawką tremelimumabu 300 mg opiera się na zbiorczych danych (pula danych dotyczących HCC) uzyskanych od 462 pacjentów z HCC uczestniczących w badaniu HIMALAYA oraz w innym badaniu z udziałem pacjentów z HCC, Badaniu 22. Najczęstszymi (>10%) działaniami niepożądanymi była wysypka (32,5%), świąd (25,5%), biegunka (25,3%), ból brzucha (19,7%), zwiększona aktywność transaminazy asparaginianowej/zwiększona aktywność transaminazy alaninowej (18,0%), gorączka (13,9%), niedoczynność tarczycy (13,0%), kaszel/kaszel z odkrztuszaniem (10,8%), obrzęki obwodowe (10,4%) i zwiększenie aktywności lipazy (10,0%) (patrz Tabela 4). Najczęstszymi ciężkimi działaniami niepożądanymi (stopnia ≥ 3. według NCI CTCAE) jest zwiększenie aktywności transaminazy asparaginianowej/zwiększenie aktywności transaminazy alaninowej (8,9%), zwiększenie aktywności lipazy (7,1%), zwiększenie aktywności amylazy (4,3%) i biegunka (3,9%). Najczęstszymi poważnymi działaniami niepożądanymi były: zapalenie jelita grubego (2,6%), biegunka (2,4%), zapalenie płuc (2,2%) i zapalenie wątroby (1,7%). Częstość zakończenia badanego leczenia z powodu działań niepożądanych wynosiła 6,5%. Najczęstszymi działaniami niepożądanymi prowadzącymi do zakończenia leczenia były: zapalenie wątroby (1,5%) i zwiększenie aktywności transaminazy asparaginianowej/zwiększenie aktywności transaminazy alaninowej (1,3%).
WSKAZANIA DO STOSOWANIA
Niedrobnokomórkowy rak płuca (NDRP)
Lek IMFINZI® w monoterapii jest wskazany w leczeniu miejscowo zaawansowanego, nieoperacyjnego niedrobnokomórkowego raka płuca (NDRP) u pacjentów dorosłych, u których stwierdza się ekspresję PD-L1 na ≥ 1% komórek guza oraz u których nie nastąpiła progresja choroby po chemioradioterapii z zastosowaniem pochodnych platyny.
Lek IMFINZI® w skojarzeniu z tremelimumabem i chemioterapią opartą na pochodnych platyny jest wskazany w leczeniu pierwszego rzutu u dorosłych pacjentów z NDRP w stadium rozsiewu, przy jednoczesnym braku mutacji aktywującej w genie receptora naskórkowego czynnika wzrostu (ang. epidermal growth factor receptor, EGFR) lub mutacji genu kinazy chłoniaka anaplastycznego (ang. anaplastic lymphoma kinase, ALK).
Drobnokomórkowy rak płuca (DRP)
Lek IMFINZI® w skojarzeniu z etopozydem i karboplatyną lub cisplatyną jest wskazany w pierwszej linii leczenia osób dorosłych z rozległym drobnokomórkowym rakiem płuca (rozległym DRP).
Rak dróg żółciowych (RDŻ)
Lek IMFINZI® w skojarzeniu z gemcytabiną i cisplatyną jest wskazany w pierwszej linii leczenia osób dorosłych z nieoperacyjnym lub rozsianym rakiem dróg żółciowych (RDŻ).
Rak wątrobowokomórkowy (ang. hepatocellular carcinoma, HCC)
Lek IMFINZI® w skojarzeniu z tremelimumabem jest wskazany w leczeniu pierwszego rzutu u dorosłych z zaawansowanym lub nieoperacyjnym rakiem wątrobowokomórkowym (HCC).
PEŁNA INFORMACJA O LEKU IMFINZI®
ZGŁASZANIE DZIAŁAŃ NIEPOŻĄDANYCH ZWIĄZANYCH Z PRODUKTAMI FIRMY ASTRAZENECA

