NIE CZEKAJ – LECZ SKUTECZNIE OD POCZĄTKU

Nowy standard leczenia HER2-dodatniego zaawansowanego raka piersi1-3
Skuteczność i bezpieczeństwo


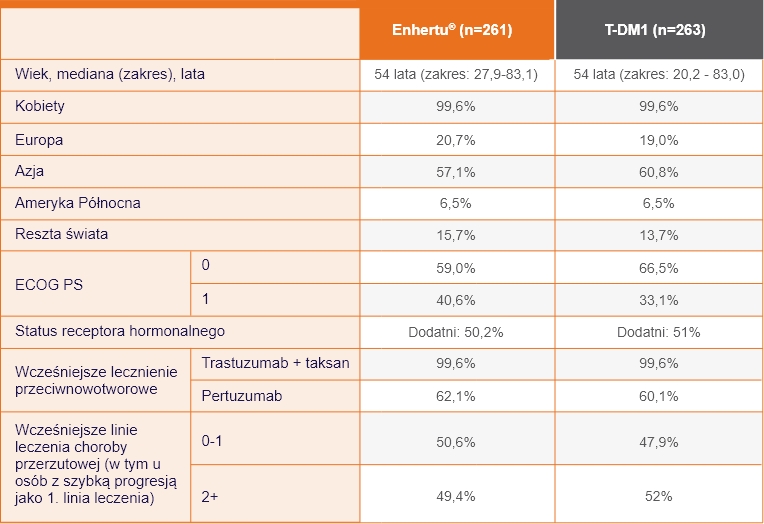
Miejsca przerzutów1
- a. HER2 IHC3+ lub IHC2+/ISH+ na podstawie centralnego potwierdzenia.
- b. Progresja w trakcie lub <6 miesięcy po zakończeniu leczenia uzupełniającego z udziałem trastuzumabu i taksanu.
- 1. Cortés, J., Hurvitz, S.A., Im, SA. I wsp. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-Breast03 trial. Nat Med (2024).
Skuteczność
(Data odcięcia: 20 listopada 2023r.)1
>2 lat mediana czasu wolnego od progresji (mPFS) w ocenie badacza w grupie Enhertu®1,4
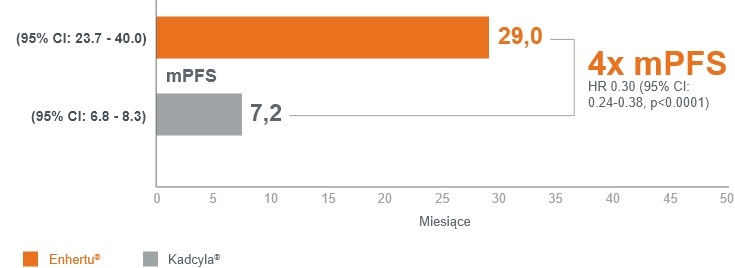
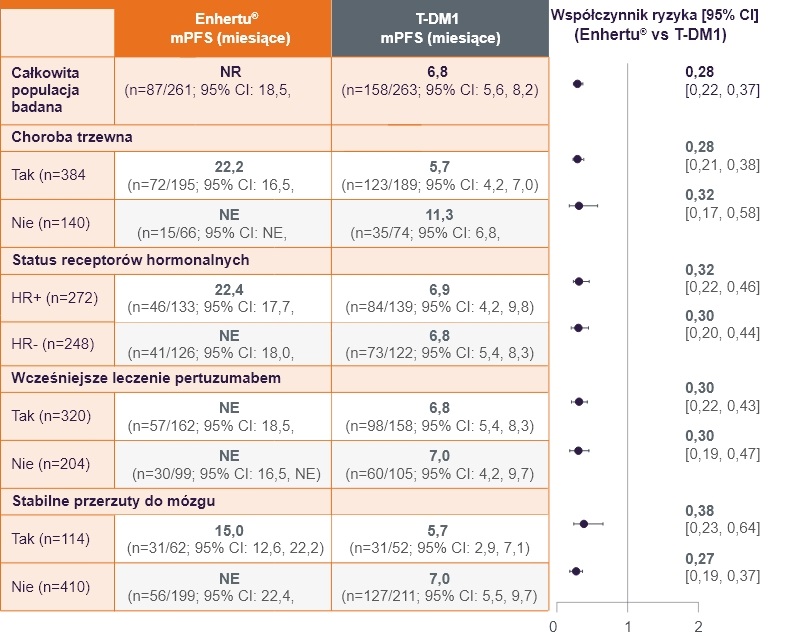
Podobne wyniki mPFS obserwowano we wszystkich predefiniowanych podgrupach leczonych produktem Enhertu®2.
- 1. Cortés, J., Hurvitz, S.A., Im, SA. I wsp. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-Breast03 trial. Nat Med (2024).
- 2. Cortés J i wsp. Prezentacja na: ESMO Virtual Congress 2021; September 17-21, 2021. prezentacja 2525.2. Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer N Engl J Med 2022;386:1143-54.DOI: 10.1056/NEJMoa2115022
Czas całkowitego przeżycia
(Data odcięcia: 20 listopada 2023r.)1
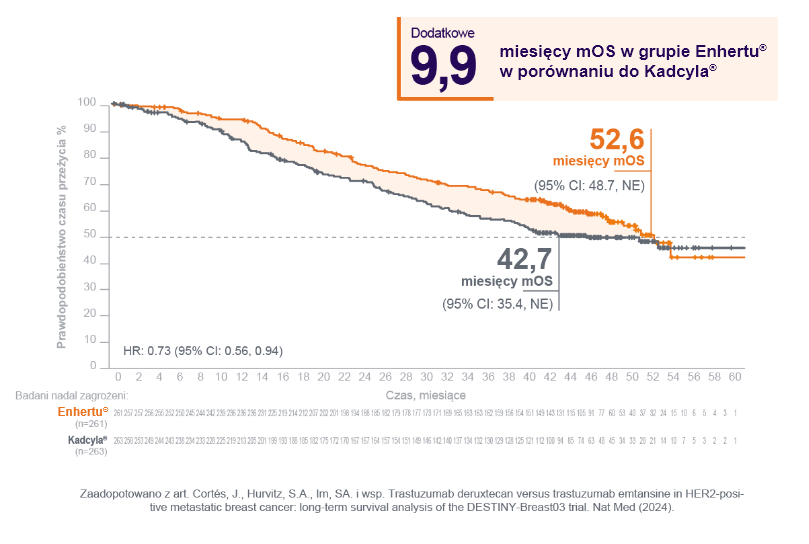
(mediana 43 miesiące) Enhertu® wykazało
klinicznie i statystycznie istotną poprawę
przeżycia całkowitego.
- 1. Cortés, J., Hurvitz, S.A., Im, SA. I wsp. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-Breast03 trial. Nat Med (2024).
(Data odcięcia: 20 listopada 2023r.)1
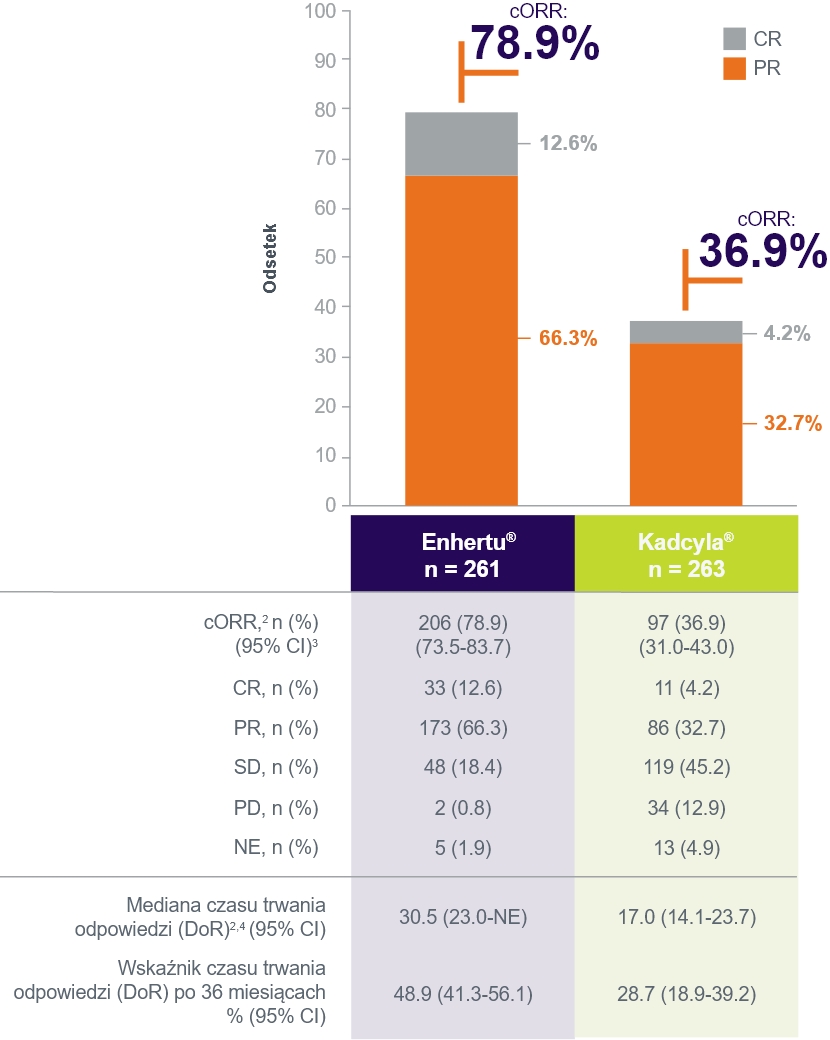
- 1. Cortés, J., Hurvitz, S.A., Im, SA. I wsp. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-Breast03 trial. Nat Med (2024).
- 2. W ocenie badacza.
- 3. Na podstawie metody Cloppera-Pearsona dla pojedynczej proporcji i różnicy 2 proporcji z korektą ciągłości.
- 4. Mediana pochodzi z analizy Kaplana-Meiera. Przedział ufności (CI) dla mediany obliczono metodą Brookmeyera-Crowleya.
Najlepsza procentowa zmiana w stosunku do wartości wyjściowej sumy średnic mierzalnych guzów (eksploracyjny punkt końcowy)
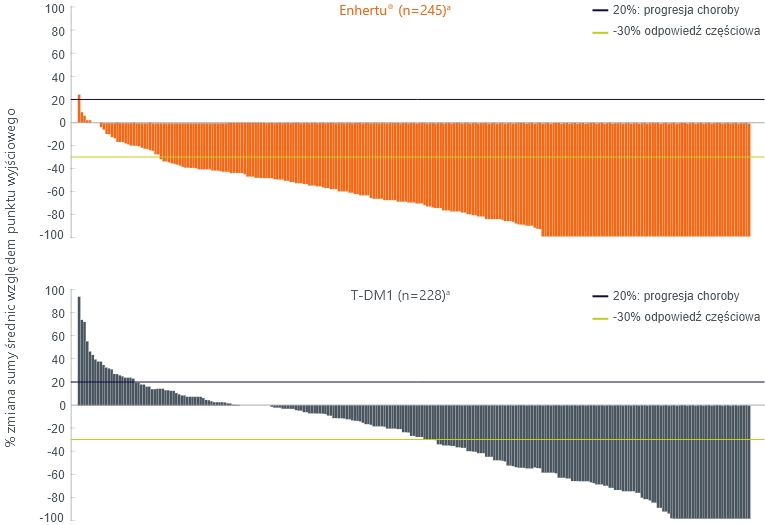
- a. Włączono tylko pacjentów z mierzalną chorobą w punkcie początkowym i co najmniej jedną oceną zmiany docelowej po ocenie wyjściowej.
- 1.Cortés J i wsp. Prezentacja na: ESMO Virtual Congress 2021; September 17-21, 2021. prezentacja 2525.2. Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer N Engl J Med 2022;386:1143-54.DOI: 10.1056/NEJMoa2115022
Bezpieczeństwo
(Data odcięcia: 20 listopada 2023r.)1
W badaniu DESTINY-Breast03 wyszczególniono działania
niepożądane występujące u ≥20% pacjentów1
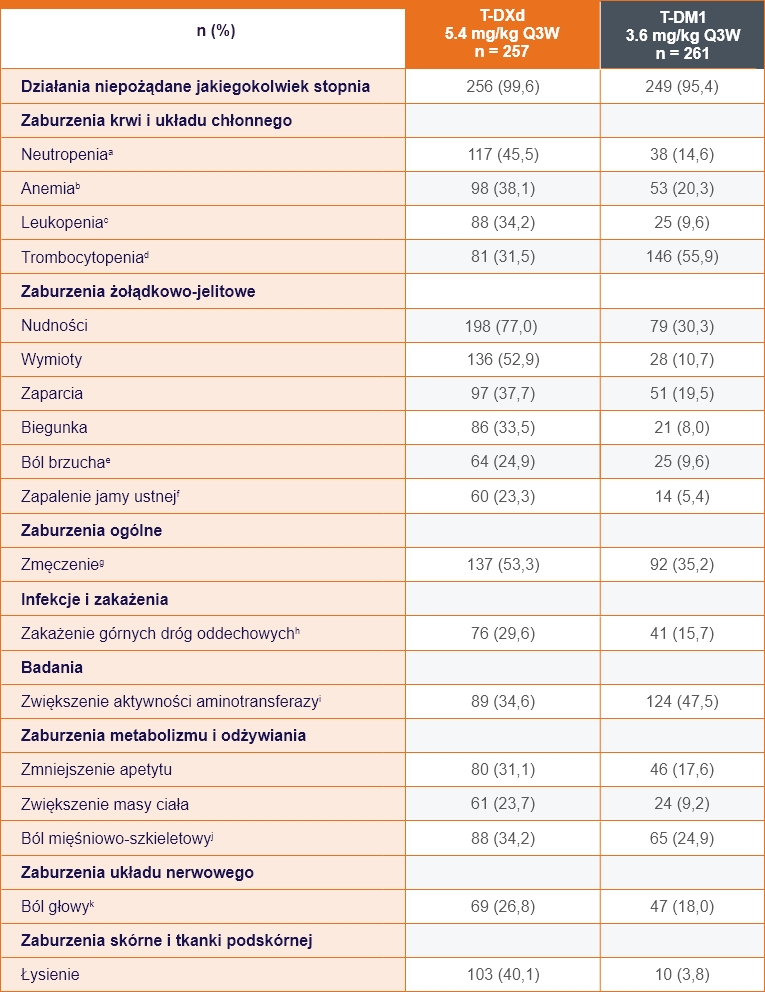
- aKategoria ta obejmuje preferowane terminy: zmniejszona liczba neutrofilów, neutropenia.
- bKategoria ta obejmuje preferowane terminy: zmniejsenie stężenia hemoglobiny, zmniejszenie liczby czerwonych krwinek, niedokrwistość i zmniejszenie hematokrytu.
- cKategoria ta obejmuje preferowane terminy: ilość białych krwinek, leukopenia.
- dKategoria ta obejmuje preferowane terminy: zmniejszenie liczby płytek krwi, małopłytkowość.
- eKategoria ta obejmuje preferowane terminy: dyskomfort w jamie brzusznej, ból brzucha, ból w dolnej części brzucha, ból w górnej części brzucha i ból żołądkowo-jelitowy.
- fKategoria ta obejmuje preferowane terminy: zapalenie jamy ustnej, afty, owrzodzenie jamy ustnej, nadżerka błony śluzowej jamy ustnej, pęcherze na błonie śluzowej jamy ustnej i wykwity na błonie śluzowej jamy ustnej.
- gKategoria ta obejmuje preferowane terminy: zmęczenie, astenia, złe samopoczucie i letarg.
- hKategoria ta obejmuje preferowane terminy: grypa, choroba grypopodobna i infekcja górnych dróg oddechowych.
- iKategoria ta obejmuje preferowane terminy: Zwiększenie aktywności aminotransferazy, zwiększenie aktywności aminotransferazy asparaginianowej, zwiększenie aktywności aminotransferazy alaninowej, zwiększenie aktywności gamma-glutamylotransferazy, nieprawidłowe wyniki testów wątrobowych, nieprawidłowe wyniki badań czynności wątroby i podwyższone wyniki testów czynnościowych wątroby.
- jKategoria ta obejmuje preferowane terminy: ból pleców, bóle mięśni, bóle kończyn, bóle mięśniowo-szkieletowe, skurcze mięśni, bóle kości, bóle szyi, bóle mięśniowo-szkieletowe w klatce piersiowej i dyskomfort kończyn.
- kKategoria ta obejmuje preferowane terminy: migrena, ból głowy, ból zatok.
- 1. Cortés, J., Hurvitz, S.A., Im, SA. I wsp. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-Breast03 trial. Nat Med (2024).
Śródmiąższowa choroba płuc (ILD) i nieinfekcyjne zapalenie płuc
W badaniu DESTINY-Breast03 miały miejsce zgłoszenia śródmiąższowej choroby płuc/nieinfekcyjnego zapalenia płuc. Większość zdarzeń miało nasilenie w stopniu 1. lub 2.
Nie zaobserowano zdarzeń uznanych za śródmiąższową chorobę płuc/nieinfekcyjne zapalenie płuc związanych ze stosowaniem leku Enhertu® (T-DXd) w nasileniu 4. lub 5. stopnia1

(Data odcięcia: 20 listopada 2023r.)1
-
Całkowita częstość występowania śródmiąższowej choroby płuc/nieinfekcyjnego zapalenia płuc wynosiła 16,7% w grupie leczonej DXd oraz 3,4% w grupie leczonej T-DM1.
-
Nie zaobserowano zdarzeń uznanych za śródmiąższową chorobę płuc/nieinfekcyjne zapalenie płuc związanych ze stosowaniem leku Enhertu w nasileniu 4. lub 5. stopnia.
BADANIA WYKONYWANE W PRZYPADKU PODEJRZENIA ŚRÓDMIĄŻSZOWEJ CHOROBY PŁUC/ZAPALENIA PŁUC
Należy niezwłocznie zbadać wszelkie oznaki choroby śródmiąższowej płuc/zapalenia płuc.
W przypadku podejrzenia śródmiąższowej choroby płuc/zapalenia płuc należy rozważyć przeprowadzenie dalszych ocen, które powinny obejmować2,3:
-
tomografię komputerową wysokiej rozdzielczości (HRCT)4
-
konsultację lekarza pulmonologa (konsultacja choroby zakaźnej zgodnie zewskazaniami klinicznymi)
-
bronchoskopię i płukanie oskrzelowo-pęcherzykowe, jeśli jest to kliniczniewskazane i wykonalne testy czynnościowe płuc (w tym zdolność dyfuzyjna FVC i CO) orazpulsoksymetrię (SpO2) kliniczne badania laboratoryjne:
-
gazometrię krwi tętniczej, jeśli jest to klinicznie wskazane
-
posiew krwi, morfologię krwi, różnicową liczbę białych krwinek, białko
-
C-reaktywne (CRP), markery związane ze śródmiąższowym zapaleniem płuc
-
(KL-6, SP-A, SP-D)5
-
test na Covid-19 (SARS-CoV-2).
-
Postępowanie w przypadku podejrzenia śródmiąższowej choroby płuc/zapalenia płuc w związku ze stosowaniem produktu leczniczego ENHERTU®:
-
Celem leczenia choroby śródmiąższowej płuc jest zahamowanie stanu zapalnego i zapobieganie nieodwracalnemu zwłóknieniu, które może prowadzić do zgonu6. Uważa się, że leczenie ortykosteroidami jest najskuteczniejsze w fazie zapalnej choroby śródmiąższowej płuc7. Czasami choroba śródmiąższowa płuc może mieć ostry przebieg i szybko się rozwijać. W przypadku podejrzenia śródmiąższowej choroby płuc należy niezwłocznie wdrożyć odpowiednie postępowanie zgodnie z poniższymi wytycznymi dotyczącymi postępowania w przypadku podejrzenia śródmiąższowej choroby płuc i skorygować je w przypadku rozpoznania innej etiologii.
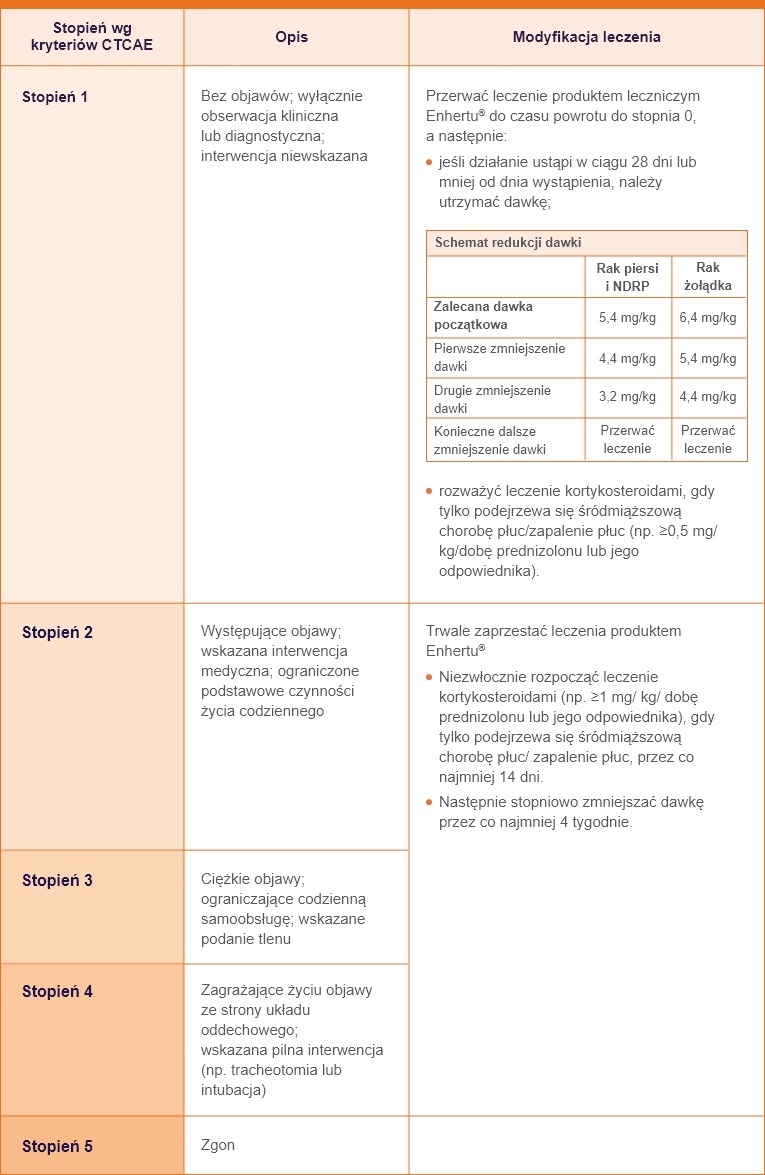
Stopnie według kryteriów NCI-CTCAE (National Cancer Institute Common Terminology Criteria for Adverse Events)8
Tematy do omówienia podczas wizyty pacjenta
(pierwsza lub kolejne)
Podczas pierwszej wizyty (przed przepisaniem leku ENHERTU®) należy:
-
poinformować pacjenta, że mogą wystąpić ciężkie i potencjalnie śmiertelne,
-
działania niepożądane w postaci chorób płuc,
-
sprawdzić, czy u pacjenta w wywiadzie występuje śródmiąższowa choroba płuc/ zapalenie płuc albo współistniejące choroby płuc, oraz leczenie kortykosteroidami zbadać, czy są podmiotowe i przedmiotowe objawy problemów z płucami,
-
poinformować pacjenta, że wczesna diagnoza i odpowiednie leczenie w przypadku wystąpienia śródmiąższowej choroby płuc/zapalenia płuc są niezbędne, aby ograniczyć poważne następstwa do minimum,
-
poinstruować pacjenta, aby natychmiast skontaktował się z lekarzem, jeśli wystąpią nawet łagodne oznaki lub objawy choroby śródmiąższowej płuc/zapalenia płuc,
-
ponieważ niektóre zdarzenia mogą się szybko pogorszyć, jeśli nie są leczone,
-
Pacjent powinien natychmiast zwrócić się o pomoc medyczną i powinien pokazać Kartę Ostrzeżeń dla Pacjenta lekarzowi(-om) w innej placówce(-kach) zdrowia, jeśli lekarz onkolog prowadzący nie jest dostępny powiedzieć pacjentowi, aby sam nie leczył objawów przekazać pacjentowi kartę pacjenta i omówić leczenie przed rozpoczęciem stosowania leku ENHERTU®
-
wypełnić kartę pacjenta i przypomnieć pacjentowi, aby kartę miał zawsze przy sobie.
Podczas wszystkich wizyt:
-
zbadać, czy są podmiotowe i przedmiotowe objawy problemów z płucami przypominać pacjentowi, że wczesna diagnoza i odpowiednie leczenie,
-
w przypadku wystąpienia śródmiąższowej choroby płuc/zapalenia płuc są niezbędne, aby ograniczyć zagrażające życiu powikłania do minimum,
-
przypominać pacjentowi, jak ważne jest zgłaszanie się na wizyty zgodnie z harmonogramem,
-
należy sprawdzić, czy pacjent posiada Kartę Ostrzeżeń dla Pacjenta.
Ewentualne pytania, które należy zadać pacjentom w celu wczesnego zidentyfikowania śródmiąższowej choroby płuc/zapalenia płuc:
-
Czy pacjent ostatnio kaszlał? Czy to suchy kaszel?
-
Czy wystąpiły duszności, szczególnie podczas wysiłku fizycznego lub po wysiłku?
-
Czy wystąpiły jakieś nowe problemy z oddychaniem lub drogami oddechowymi?
-
Czy nastąpiło pogorszenie istniejących problemów z drogami oddechowymi?
-
Czy pacjent miał gorączkę?
-
Czy pacjent odczuwał zmęczenie?
-
Czy pacjent pali papierosy albo używa e-papierosów?
- 1. Cortés, J., Hurvitz, S.A., Im, SA. I wsp. Trastuzumab deruxtecan versus trastuzumab emtansine in HER2-positive metastatic breast cancer: long-term survival analysis of the DESTINY-Breast03 trial. Nat Med (2024).
- 2. Kubo K, Azuma A, Kanazawa M, et al; Japanese Respiratory Society Committee. Consensus statement for the diagnosis and treatment of drug-induced lung injuries. Respir Invest. 2013; 51 (4): 260-277.
- 3. Modi S, Saura C, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. N Engl J Med.2020; 382 (7): 610-621.
- 4. Conte P, Ascierto PA, Patelli G, et al. Drug-induced interstitial lung disease during cancer therapies: expert opinion on diagnosis and treatment. ESMO Open. 2022; 7 (2): 100404.
- 5. A brief introduction to identifying and managing drug-induced interstitial lung disease. Daiichi Sankyo/AstraZeneca. PP-US-8201a-0397. Nov 2019.
- 6. Schwaiblmair M, Behr W, Haeckel T, et al. Drug induced interstitial lung disease. Open Respir Med J. 2012; 6: 63-74.
- 7. Skeoch S, Weatherley N, Swift AJ, et al. Drug-induced interstitial lung disease: a systematic review. J Clin Med. 2018; 7 (10): 356.
- 8. US Department of Health and Human Services. Common Terminology Criteria for Adverse Events (CTCAE), Version 5.0. Published November 27, 2017.
Inne wybrane działania niepożądane
Kryteria klasyfikacji toksyczności i częstość występowania nudności1

Kryteria klasyfikacji toksyczności i częstość występowania zmęczenia1

Kryteria klasyfikacji toksyczności i częstość występowania łysienia1

Kryteria klasyfikacji toksyczności i częstość występowania wymiotów1

Kryteria klasyfikacji toksyczności i częstość występowania zaparć1

Kryteria klasyfikacji toksyczności i częstość występowania zmniejszonego apetytu1

Kryteria klasyfikacji toksyczności i częstość występowania biegunki1

- 1. US Department of Health and Human Services. Common Terminology Criteria for Adverse Events (CTCAE), Version 5.0. Published November 27, 2017.
PL-20647
